Запись вебинара в формате видео можно посмотреть здесь.
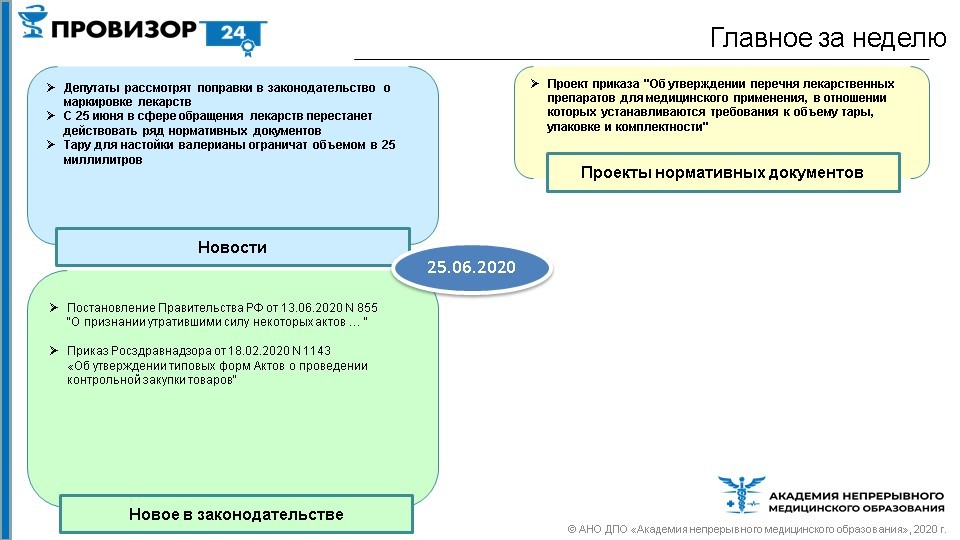
1. Продолжаем тему маркировки лекарственных препаратов. Члены Комитета Госдумы по охране здоровья одобрили поправки, которые наделяют правительство правом установить особый порядок ввода немаркированных препаратов после внедрения МДЛП. Мы следим за новостями по этой теме, и, когда появятся окончательные нормативные документы, обязательно сообщим! На текущий момент продолжаем готовиться к вступлению в силу обязательной маркировки лекарственных препаратов с 1 июля.
2. Тару для настойки боярышника и валерианы ограничат объемом не более 25 мл, экстракт элеутерококка – до 50 мл, а эликсиры из сборов лекарственных растений – до 100 мл. Соответствующий проект приказа представлен для общественного обсуждения.
Аналогичные предложения звучат, как минимум, с 2015 года. Предполагается, что это поможет снизить масштабы потребления спиртовых лекарственных настоек населением не по медицинским показаниям. Проект приказа «Об утверждении перечня лекарственных препаратов для медицинского применения, в отношении которых устанавливаются требования к объему тары, упаковке и комплектности» придет на смену приказу МЗ РФ № 47н в январе 2021 года. По сути, приказы идентичны, но как только новый приказ вступит в силу, мы проведем сравнительный анализ и расскажем, на что важно обратить внимание.
3. Вступил в силу приказ Росздравнадзора № 1143 от 18.02.2020 «Об утверждении типовых форм Актов о проведении контрольной закупки товаров». Ранее на наших вебинарах мы уже подробно разбирали тему контрольных закупок и содержания актов об их проведении. В данном приказе утверждены только непосредственно формы акты.
4. С 1 января 2021 года перестанет действовать ряд нормативных актов в сфере обращения лекарств. Об этом говорится в постановлении Правительства № 855 от 13.06.2020 «О признании утратившими силу некоторых актов…».
Перечень нормативных документов, которые сейчас учитываются при контроле и надзоре, представлен ниже.
Постановления Правительства:
1. Постановление Правительства РФ от 3 сентября 2010 г. № 674 «Об утверждении Правил уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств».
2. Постановление Правительства РФ от 3 сентября 2010 г. № 683 «Об утверждении Правил аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения».
3. Пункт 3 изменений, которые вносятся в акты Правительства РФ по вопросам предоставления государственных услуг в сфере обращения лекарственных средств, утвержденных постановлением Правительства РФ от 5 декабря 2011 г. № 1001 «О внесении изменений в некоторые акты Правительства Российской Федерации по вопросам предоставления государственных услуг в сфере обращения лекарственных средств» .
4. Пункты 123 и 125 изменений, которые вносятся в акты Правительства РФ по вопросам деятельности Министерства здравоохранения РФ, утвержденных постановлением Правительства РФ от 4 сентября 2012 г. № 882 «О внесении изменений в некоторые акты Правительства Российской Федерации по вопросам деятельности Министерства здравоохранения Российской Федерации».
5. Постановление Правительства РФ от 16 января 2016 г. № 8 «О внесении изменений в Правила уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств».
Приказы МЗ РФ:
1. Приказ Министерства здравоохранения РФ от 16 июля 1997 г. № 214 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)».
2. Приказ Министерства здравоохранения РФ от 16 октября 1997 г. № 305 «О нормах отклонений, допустимых при изготовлении лекарственных средств и фасовке промышленной продукции в аптеках».
3. Приказ Министерства здравоохранения РФ от 21 октября 1997 г. № 308 «Об утверждении Инструкции по изготовлению в аптеках жидких лекарственных форм».
4. Приказ Министерства здравоохранения РФ от 21 октября 1997 г. № 309 «Об утверждении Инструкции по санитарному режиму аптечных организаций (аптек)».
5. Приказ Министерства здравоохранения РФ от 12 ноября 1997 г. № 330 «О мерах по улучшению учета, хранения, выписывания и использования наркотических средств».
6. Приказ Министерства здравоохранения РФ от 20 июля 2001 г. № 284 «Об утверждении норм естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности».
7. Приказ Министерства здравоохранения РФ от 17 апреля 2002 г. № 124 «Об утверждении формы для учета данных о лекарственных средствах».
8. Приказ Министерства здравоохранения РФ от 16 мая 2003 г. № 205 «О внесении изменений и дополнений в Приказ Минздрава России от 12.11.1997 № 330».
9. Приказ Министерства здравоохранения РФ от 28 мая 2003 г. № 224 «Об утверждении Положения об информационной системе, обеспечивающей субъекты обращения лекарственных средств необходимой информацией».
10. Приказ Министерства здравоохранения и социального развития РФ от 9 января 2007 г. № 2 «Об утверждении норм естественной убыли при хранении лекарственных средств в аптечных учреждениях (организациях), организациях оптовой торговли лекарственными средствами и учреждениях здравоохранения».
11. Приказ Министерства здравоохранения и социального развития РФ от 26 июня 2008 г. № 296н «О внесении изменения в Приказ Министерства здравоохранения Российской Федерации от 12 ноября 1997 г. № 330 «О мерах по улучшению учета, хранения, выписывания и использования наркотических средств и психотропных веществ».
12. Приказ Министерства здравоохранения и социального развития РФ от 27 июля 2010 г. № 553н «Об утверждении видов аптечных организаций».
13. Приказ Министерства здравоохранения и социального развития РФ от 26 августа 2010 г. № 757н «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении лекарственных препаратов для медицинского применения».
14. Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н «Об утверждении Правил надлежащей лабораторной практики».
15. Приказ Министерства здравоохранения РФ от 21 декабря 2016 г. № 979н «Об утверждении требований к объему тары, упаковке и комплектности лекарственных препаратов для медицинского применения».
16. Приказ Министерства здравоохранения РФ от 8 февраля 2017 г. № 47н «Об утверждении перечня лекарственных препаратов для медицинского применения, в отношении которых устанавливаются требования к объему тары, упаковке и комплектности».
Проверка в отношении аптечной организации может осуществляется в рамках федерального государственного надзора, лицензионного контроля или выборочного контроля (последнее касается непосредственно качества лекарственных препаратов). Федеральный государственный надзор, как и лицензионный контроль, делится на плановые и внеплановые проверки. Проверочные листы используются в плановых проверках в рамках федерального государственного надзора в сфере обращения лекарственных средств (в соответствии с приказом Росздравнадзора № 9438). Для случаев внеплановой проверки или лицензионного контроля проверочные листы в настоящее время не утверждены (в рамках лицензионного контроля готовятся проекты документов по включению проверочных листов), поэтому необходимо руководствоваться приказом Росздравнадзора № 4043, который устанавливает перечни правовых актов, используемых при государственном надзоре.
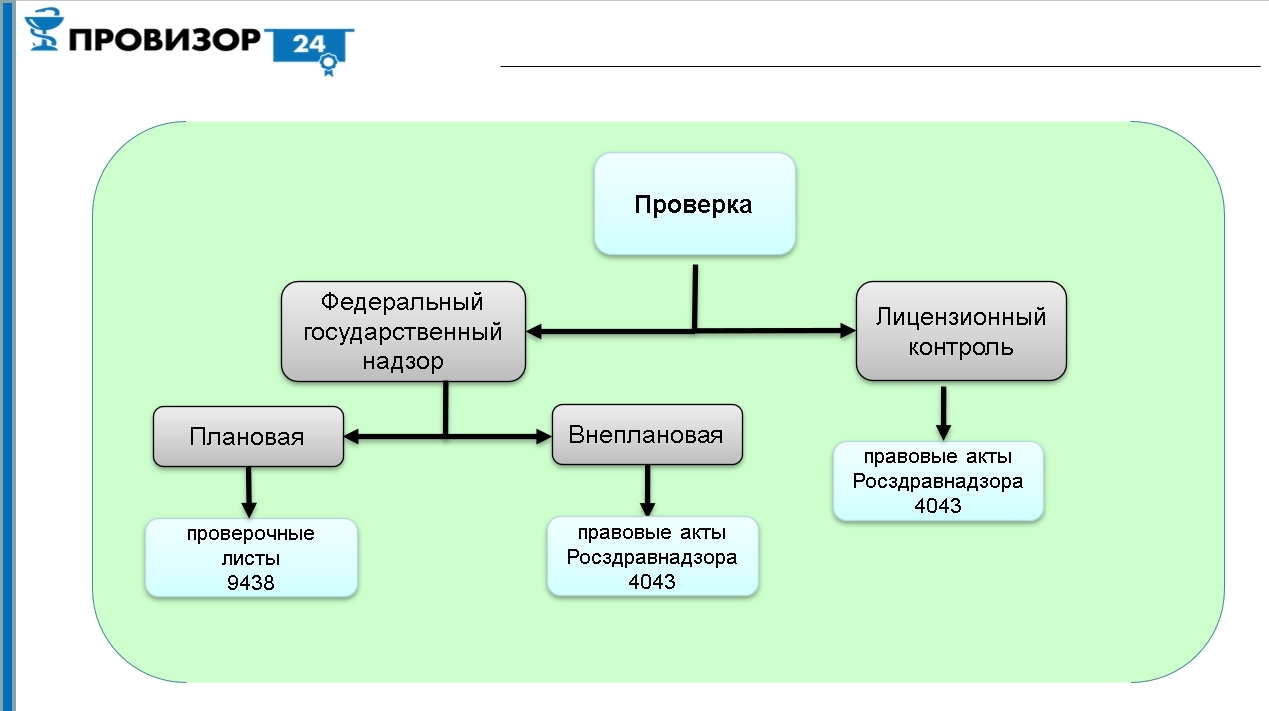
Рассмотрим подробнее основные нормативные документы, используемые при проведении контрольно-надзорных мероприятий, в разрезе разных видов проверок.
Постановление Правительства РФ от 03.09.2010 № 674 «Об утверждении Правил уничтожения недоброкачественных ЛС, фальсифицированных ЛС и контрафактных ЛС».
В рамках федерального государственного надзора при плановой проверке используется список контрольных вопросов:
1. Имеется ли договор с организацией (п.8 Правил)?
2. Что указывается в актах об уничтожении ЛС (п.11 Правил)?
3. Когда составляются акты об уничтожении ЛС (п.12 Правил)?
4. В какое время направляется акт об уничтожении лекарственных средств в уполномоченный орган (п.13 Правил)?
При внеплановой проверке проверяются п.2, 4, 7-13 Правил.
При лицензионном контроле проверяются п.1-14 Правил.
С 2021 года вместо указанного документа будет действовать новый приказ: сейчас это проект «Об утверждении правил уничтожения (утилизации) недоброкачественных ЛС, фальсифицированных ЛС и контрафактных ЛС». Но по проверяемым пунктам, вероятнее всего, принципиальной разницы не будет, и вопросы, используемые при плановой проверке в рамках федерального государственного надзора, останутся те же.
Приказ Министерства здравоохранения РФ от 16 июля 1997 г. № 214 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)». Перечня контрольных вопросов в этом приказе нет, поэтому в случае плановой проверки в рамках федерального государственного надзора, указанный приказ не рассматривается. Но он присутствует в перечне нормативных документов при проведении внеплановой проверки или лицензионного контроля (в соответствии с приказом Росздравнадзора № 4043). Документ устаревший (1997 года), поэтому сейчас вместо него уже работает Приказ Министерства здравоохранения РФ от 26.10.2015 № 751н «Об утверждении правил изготовления и отпуска ЛП для медицинского применения АО, ИП, имеющими лицензию на фармацевтическую деятельность» (присутствует и в лицензионном контроле и рамках федерального государственного надзора).
Приказ Минздрава России от 21.10.1997 № 308 «Об утверждении Инструкции по изготовлению в аптеках жидких лекарственных форм». На текущий момент при проверках используются все положения Инструкции, но документ утратит силу, а на его смену придет Приказ Министерства здравоохранения РФ от 26.10.2015 N 751н «Об утверждении правил изготовления и отпуска ЛП для медицинского применения АО, ИП, имеющими лицензию на фармацевтическую деятельность».
Приказ Министерства здравоохранения Российской Федерации от 21.10.1997 № 309 «Об утверждении Инструкции по санитарному режиму аптечных организаций (аптек)». Перечня контрольных вопросов в этом приказе нет, поэтому в случае плановой проверки в рамках федерального государственного надзора, указанный приказ не рассматривается. Но он присутствует в перечне нормативных документов при проведении внеплановой проверки или лицензионного контроля. В этом случае используются все положения Инструкции:
1. Общие положения;
2. Термины и определения;
3. Санитарные требования к помещениям и оборудованию аптек;
4. Санитарные требования к помещениям и оборудованию асептического блока;
5. Санитарное содержание помещений, оборудования, инвентаря;
6. Санитарно-гигиенические требования к персоналу аптек;
7. Санитарные требования к получению, транспортировке и хранению очищенной воды и воды для инъекций;
8. Санитарные требования при изготовлении лекарственных средств в асептических условиях;
9. Санитарные требования при изготовлении нестерильных лекарственных форм;
10. Объекты микробиологического контроля в аптеках.
Ранее было много рассуждений и даже судебных примеров того, как используется этот приказ для производственной аптеки и аптек готовых лекарственных форм. В настоящее время речь идет о том, что этот приказ уходит, но заменяющего нормативного документа пока нет.
Приказ Министерства здравоохранения Российской Федерации от 12.11.1997 № 330 «О мерах по улучшению учета, хранения, выписывания и использования наркотических средств и психотропных веществ».
Весь документ используется в рамках лицензионного контроля и при внеплановой проверке в рамках федерального государственного надзора. В рамках плановой проверки указанного приказа нет в чек-листах.
На какие пункты и приложения приказа (в случае проведения проверки) важно обратить внимание:
2.1. Возложить на руководителей ЛПУ персональную ответственность за учет, сохранность, отпуск, назначение и использование НС и ПВ специальных рецептурных бланков, в соответствии с Приложениями 1 - 11, введенными данным Приказом.
2.2. Обеспечивать ЛПУ специальными рецептурными бланками на НС и ПВ, получаемые с аптечных складов (баз). Запас специальных рецептурных бланков на НС и ПВ в органах управления здравоохранением и ЛПУ не должен превышать месячной потребности.
2.4. Обязать лечащих врачей назначение и использование НС и ПВ, независимо от ЛФ, оформлять записями в истории болезни и листке назначения с указанием наименования ЛФ НС и ПВ, его количества и дозировки.
2.5. Обязать лечащих или дежурных врачей использованные ампулы из-под НС и ПВ сдавать в этот же день, за исключением выходных и праздничных дней, заместителю руководителя по лечебной части, а в учреждениях, где он отсутствует - руководителю ЛПУ. Уничтожение использованных ампул производить не реже одного раза в 10 дней комиссией под председательством руководителя с оформлением соответствующего акта по установленной форме (Приложение 10).
- Положение о списании и уничтожении НС и ПВ и специальных рецептов, не использованных онкологическими больными (Приложение 6).
- Журнал учета неиспользованных рецептов и остатков НС и ПВ сданных родственниками умерших онкологических больных.
- Правила хранения и учета НС в контрольно-аналитических лабораториях (Приложение 8).
- Акт на уничтожение использованных ампул из-под НС и ПВ (Приложение 10).
- Форму внеочередного донесения, представляемого Министерству здравоохранения РФ о хищении и краже наркотиков из аптечных и ЛПУ (Приложение 11).
Замены данного приказа пока нет.
Приказ Министерства здравоохранения и социального развития Российской Федерации от 27.07.2010 № 553н «Об утверждении видов аптечных организаций».
Приказ присутствует в перечне нормативных документов при проведении проверки в рамках лицензионного контроля (касается видов аптечных организаций).
Приказ Минздравсоцразвития России от 26.08.2010 № 757н «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении лекарственных препаратов для медицинского применения».
Данный приказ используется при осуществлении внеплановой проверки в рамках федерального государственного надзора (основание проведения мониторинга, сроки сообщений и отчетов в Росздравнадзор). Документ устаревший, и на его смену в 2017 году пришел другой приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора». Фармаконадзор и является мониторингом безопасности лекарственных препаратов, поэтому приказ № 757н лишь повторяет новый приказ.
Другие нормативные документы, которые утратят силу с 1 января 2021 года, никак не задействованы ни в перечне контрольных вопросов, ни в перечне документов, используемых Росздравнадзором при проведении проверок.
Мы продолжаем следить за изменениями законодательства в сфере фармации, и будем и дальше держать вас в курсе о появлении новых нормативных актов и проводить их подробный анализ!