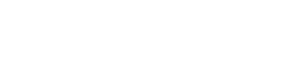Судебная практика 2017 года. Часть 2
Основные нарушения, допускаемые аптечными организациями при осуществлении фармацевтической деятельности. Часть 2
Эта статья в формате видеолекции здесь
Эта статья в формате видеолекции здесь
Все нарушения, выявленные контролирующими органами за 2017 год, можно разделить на несколько основных групп:
- условия хранения (температура и влажность воздуха);
- сроки годности лекарственных препаратов;
- помещения и оборудование;
- нарушения приказов 646н и 647н;
- предметно-количественный учет (ПКУ);
- отпуск лекарственных препаратов (ранее – приказ 785н, сейчас – приказ 403н);
- образование специалистов;
- контроль качества лекарственных препаратов и медицинских изделий;
- изготовление (и производство) лекарственных препаратов;
- перевозка;
- жизненно необходимые и важнейшие лекарственные препараты (ЖНВЛП).
В 1 части данной статьи были подробно рассмотрены нарушения условий хранения, сроков годности, требований к помещениям и оборудованию и требований приказов 646н и 647н.
Разберем оставшиеся группы нарушений.
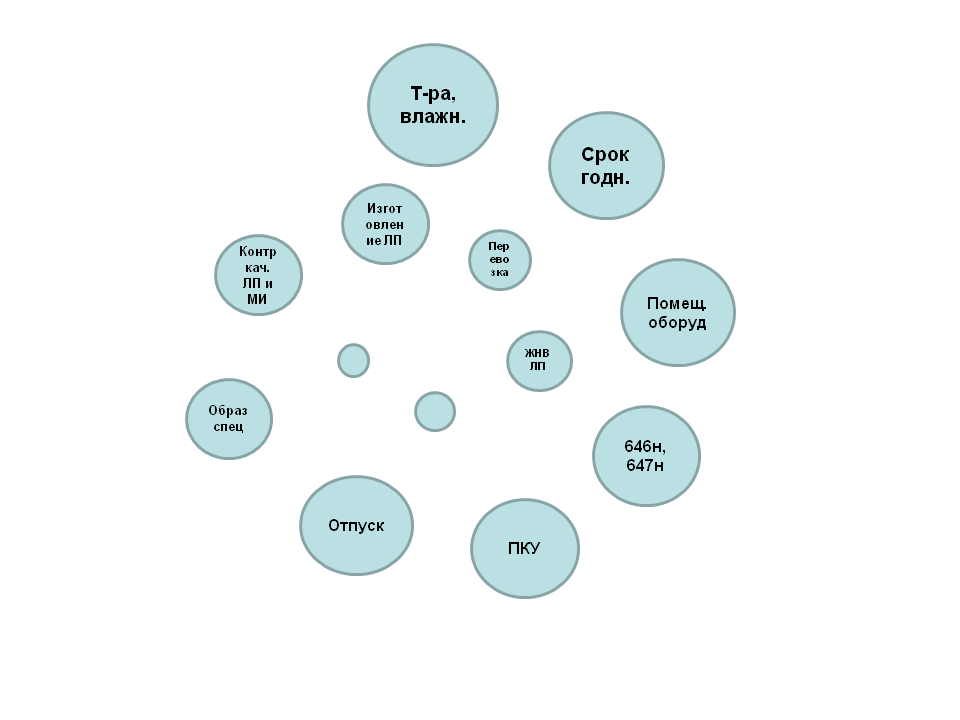
V. Нарушения требований к лекарственным препаратам, подлежащим предметно-количественному учету
Основные нарушения, допускаемые аптеками:
- не ведется предметно-количественный учет.
Пример.
Как следует из материалов дела, ООО «…» не вносит сведения о поступлении лекарственных препаратов, подлежащих предметно-количественному учету, в соответствующий журнал, а также сведения об их отпуске, что подтверждается:
На момент проверки остаток лекарственного препарата «Терпинкод» составил 3 упаковки, в то время как в журнале учета лекарственных препаратов, подлежащих предметно-количественному учету остаток на начало февраля 2017 составил 2 упаковке, других записей нет.
Лекарственный препарат «Голдлайн капсулы 10 мг № 90» серии 061016 на остатке 3 уп., не соответствует данным журнала учета 1 уп.
Также в журнале отсутствуют сведения о поступлении в феврале и марте 2017 и об отпуске лекарственного препарата «Мидриацил» и других лекарственных препаратов, подлежащих предметно-количественному учету.
- журнал не соответствует утвержденной форме.
Пример 1.
При проверке установлено, что учет лекарственных средств для медицинского применения, подлежащих предметно-количественному учету:
- «Тропикамид , капли глазные 1 % фл. капельницы 5 мл №2»,
- «Мидриацил, капли глазные 1 % фл. капельницы 15 мл» ведется в журналах.
Однако форма журналов учета не соответствует форме, утвержденной для организаций оптовой торговли лекарственными средствами приказом Министерства здравоохранения РФ от 17.06.2013 № 378н.
Форма, по которой ведется учет лекарственных препаратов в ООО «…», предназначена для ведения учета лекарственных препаратов аптечными организациями и индивидуальными предпринимателям, в связи с чем отсутствуют сведения о получателе лекарственных препаратов, номере и дате документа, по которому лекарственные препараты отпущены.
Пример 2.
МУП «…» в ходе проверки был представлен «Журнал учета сильнодействующих, ядовитых медикаментов и этилового спирта по аптеке на 2006 год» (далее - Журнал учета спирта). На титульном листе Журнала учета спирта указано, что форма утверждена приказом МЗ СССР №1031 от 20.10.1982 г.
Журнал учета спирта не соответствует установленной форме в части граф «Приход»: в старой форме графы «№ документа и дата» и «Количество», в форме журнала Приложения 2 должны быть графы «Поставщик, N и дата документа» и «Количество»; в части граф «Расход»: не соответствуют виды расхода; отсутствует графа «Подпись уполномоченного лица».
- журнал заведен не на один календарный год.
Пример.
На момент проверки предъявлены три журнала учета операций, связанных с обращением лекарственных средств для медицинского применения, подлежащих предметно-количественному учету. В Журналах ведется учет конкретных наименований лекарственных препаратов не один календарный год, а с октября 2015, 2016 год, по февраль 2017г.:
- журнал ПКУ не скреплен руководителем юридического лица.
Пример.
Аптечным пунктом предоставлены два журнала за 2015, 2016 гг.: «Журнал учёта препаратов предметно-количественного учета». Название и форма журнала не соответствуют требованиям приказа Минздрава России от 17.06.2013 N 378н. Название журнала в соответствии с действующим приказом «Журнал учета операций, связанных с обращением лекарственных средств для медицинского применения». Кроме того, предъявленные журналы скреплены подписью руководителя аптечного пункта, а не руководителем юридического лица.
- отсутствуют рецептурные бланки, подтверждающие отпуск лекарственных препаратов, подлежащих предметно-количественному учету.
Пример.
При выборочной проверке приходных накладных выявлены товарные накладные, в соответствии с которыми приобретены лекарственные препараты, содержащие кодеин («Пенталгин ISN табл. №12» - 2 упаковки), сибутрамин («Голдлайн» - 7 упаковок), прегабалин («Лирика»- 3 упаковки, «Прегабалин Рихтер» - 1 упаковка).
Однако в нарушение вышеуказанных норм аптечным пунктом не представлены рецептурные бланки формы №148-1/у-88, в соответствии с которыми данные лекарственные препараты могли быть отпущены пациенту.
При анализе «Журналов учёта препаратов предметно-количественного учёта» за 2016, 2015 года установлен приход лекарственных препаратов, подлежащих также отпуску по рецептурным бланкам формы №148-1/у-88 в количестве 56 упаковок. Рецептурные бланки на момент проверки (17.05.2017) не предъявлены.
- документы не подшиты.
Пример.
При анализе записей в предъявленных журналах учета за 2015, 2016 год установлено, что регистрация операций в расходной части осуществлялась формально, так как отсутствуют документы, подтверждающие проведение расходной операции (рецептурный бланк формы N 148-1/у-88).
Приходные документы не подшиты в порядке их поступления по датам и хранятся отдельно от журналов учёта.
- нарушение требований к хранению лекарственных препаратов, подлежащих предметно-количественному учету.
Пример.
Перманганат калия сухой (поступивший в аптеку как лекарственное, а не как дезинфицирующее средство) хранится в материальной комнате №1 в отсеке металлического шкафа, не обладающим свойствами встроенного несгораемого шкафа.
В данном шкафу совместно с перманганатом калия хранятся другие лекарственные препараты.
В нарушение п.70 Правил перманганат калия сухой, подлежащий предметно-количественному учету, не хранится в металлических шкафах, опечатываемых или пломбируемых в конце рабочего дня.
При назначении административного наказания юридическому лицу учитываются характер совершенного им административного правонарушения, имущественное и финансовое положение юридического лица, обстоятельства, смягчающие административную ответственность, и обстоятельства, отягчающие административную ответственность (часть 3 статьи 4.1 КоАП РФ).
В материалах дела имеются сведения, позволяющие суду отнести заявителя к субъектам малого предпринимательства (выписка из реестра).
- ранее организация к административной ответственности по части 4 статьи 14.1 КоАП РФ не привлекалась.
- доказательства причинения вреда или реальной угрозы причинения вреда жизни и здоровью людей, в материалах дела отсутствуют (о наличии таких обстоятельств заявителем не указано),
- нарушения носят формальный характер, не затрагивают качество реализуемых лекарственных средств.
Таким образом, обстоятельства, препятствующие назначению наказания в виде предупреждения, судом не установлены.
При таких обстоятельствах, суд полагает соразмерным совершенному правонарушению назначение ООО «…» административного наказания в виде предупреждения.
Основные нарушения, допускаемые аптечными складами:
- журнал не соответствует утвержденной форме.
- журнал заведен не на один календарный год.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.) и по ст. 4.1.1 КоАП РФ (предупреждение).
- не ведется предметно-количественный учет.
Пример.
Как следует из материалов дела, ООО «…» не вносит сведения о поступлении лекарственных препаратов, подлежащих предметно-количественному учету, в соответствующий журнал, а также сведения об их отпуске, что подтверждается:
- отсутствием записей в журнале предметно-количественного учета лекарственных препаратов за февраль 2017 года до 23.03.2017 на момент осмотра;
- рецептами на отпуск лекарственных препаратов, подлежащих предметно-количественному учету, за март 2017;
- реестром поставок данных лекарственных препаратов;
- расхождением остатков на 23.03.2017.
На момент проверки остаток лекарственного препарата «Терпинкод» составил 3 упаковки, в то время как в журнале учета лекарственных препаратов, подлежащих предметно-количественному учету остаток на начало февраля 2017 составил 2 упаковке, других записей нет.
Лекарственный препарат «Голдлайн капсулы 10 мг № 90» серии 061016 на остатке 3 уп., не соответствует данным журнала учета 1 уп.
Также в журнале отсутствуют сведения о поступлении в феврале и марте 2017 и об отпуске лекарственного препарата «Мидриацил» и других лекарственных препаратов, подлежащих предметно-количественному учету.
- журнал не соответствует утвержденной форме.
Пример 1.
При проверке установлено, что учет лекарственных средств для медицинского применения, подлежащих предметно-количественному учету:
- «Тропикамид , капли глазные 1 % фл. капельницы 5 мл №2»,
- «Мидриацил, капли глазные 1 % фл. капельницы 15 мл» ведется в журналах.
Однако форма журналов учета не соответствует форме, утвержденной для организаций оптовой торговли лекарственными средствами приказом Министерства здравоохранения РФ от 17.06.2013 № 378н.
Форма, по которой ведется учет лекарственных препаратов в ООО «…», предназначена для ведения учета лекарственных препаратов аптечными организациями и индивидуальными предпринимателям, в связи с чем отсутствуют сведения о получателе лекарственных препаратов, номере и дате документа, по которому лекарственные препараты отпущены.
Пример 2.
МУП «…» в ходе проверки был представлен «Журнал учета сильнодействующих, ядовитых медикаментов и этилового спирта по аптеке на 2006 год» (далее - Журнал учета спирта). На титульном листе Журнала учета спирта указано, что форма утверждена приказом МЗ СССР №1031 от 20.10.1982 г.
Журнал учета спирта не соответствует установленной форме в части граф «Приход»: в старой форме графы «№ документа и дата» и «Количество», в форме журнала Приложения 2 должны быть графы «Поставщик, N и дата документа» и «Количество»; в части граф «Расход»: не соответствуют виды расхода; отсутствует графа «Подпись уполномоченного лица».
- журнал заведен не на один календарный год.
Пример.
На момент проверки предъявлены три журнала учета операций, связанных с обращением лекарственных средств для медицинского применения, подлежащих предметно-количественному учету. В Журналах ведется учет конкретных наименований лекарственных препаратов не один календарный год, а с октября 2015, 2016 год, по февраль 2017г.:
- «Тропикамид капли глазные 1 % фл. капельницы 5 мл №2»,
- «Мидриацил капли глазные 1 % фл. капельницы 15 мл»,
- «Тропикамид капли глазные фл. 0,5% 10 мл».
- журнал ПКУ не скреплен руководителем юридического лица.
Пример.
Аптечным пунктом предоставлены два журнала за 2015, 2016 гг.: «Журнал учёта препаратов предметно-количественного учета». Название и форма журнала не соответствуют требованиям приказа Минздрава России от 17.06.2013 N 378н. Название журнала в соответствии с действующим приказом «Журнал учета операций, связанных с обращением лекарственных средств для медицинского применения». Кроме того, предъявленные журналы скреплены подписью руководителя аптечного пункта, а не руководителем юридического лица.
- отсутствуют рецептурные бланки, подтверждающие отпуск лекарственных препаратов, подлежащих предметно-количественному учету.
Пример.
При выборочной проверке приходных накладных выявлены товарные накладные, в соответствии с которыми приобретены лекарственные препараты, содержащие кодеин («Пенталгин ISN табл. №12» - 2 упаковки), сибутрамин («Голдлайн» - 7 упаковок), прегабалин («Лирика»- 3 упаковки, «Прегабалин Рихтер» - 1 упаковка).
Однако в нарушение вышеуказанных норм аптечным пунктом не представлены рецептурные бланки формы №148-1/у-88, в соответствии с которыми данные лекарственные препараты могли быть отпущены пациенту.
При анализе «Журналов учёта препаратов предметно-количественного учёта» за 2016, 2015 года установлен приход лекарственных препаратов, подлежащих также отпуску по рецептурным бланкам формы №148-1/у-88 в количестве 56 упаковок. Рецептурные бланки на момент проверки (17.05.2017) не предъявлены.
- документы не подшиты.
Пример.
При анализе записей в предъявленных журналах учета за 2015, 2016 год установлено, что регистрация операций в расходной части осуществлялась формально, так как отсутствуют документы, подтверждающие проведение расходной операции (рецептурный бланк формы N 148-1/у-88).
Приходные документы не подшиты в порядке их поступления по датам и хранятся отдельно от журналов учёта.
- нарушение требований к хранению лекарственных препаратов, подлежащих предметно-количественному учету.
Пример.
Перманганат калия сухой (поступивший в аптеку как лекарственное, а не как дезинфицирующее средство) хранится в материальной комнате №1 в отсеке металлического шкафа, не обладающим свойствами встроенного несгораемого шкафа.
В данном шкафу совместно с перманганатом калия хранятся другие лекарственные препараты.
В нарушение п.70 Правил перманганат калия сухой, подлежащий предметно-количественному учету, не хранится в металлических шкафах, опечатываемых или пломбируемых в конце рабочего дня.
При назначении административного наказания юридическому лицу учитываются характер совершенного им административного правонарушения, имущественное и финансовое положение юридического лица, обстоятельства, смягчающие административную ответственность, и обстоятельства, отягчающие административную ответственность (часть 3 статьи 4.1 КоАП РФ).
В материалах дела имеются сведения, позволяющие суду отнести заявителя к субъектам малого предпринимательства (выписка из реестра).
- ранее организация к административной ответственности по части 4 статьи 14.1 КоАП РФ не привлекалась.
- доказательства причинения вреда или реальной угрозы причинения вреда жизни и здоровью людей, в материалах дела отсутствуют (о наличии таких обстоятельств заявителем не указано),
- нарушения носят формальный характер, не затрагивают качество реализуемых лекарственных средств.
Таким образом, обстоятельства, препятствующие назначению наказания в виде предупреждения, судом не установлены.
При таких обстоятельствах, суд полагает соразмерным совершенному правонарушению назначение ООО «…» административного наказания в виде предупреждения.
Основные нарушения, допускаемые аптечными складами:
- журнал не соответствует утвержденной форме.
- журнал заведен не на один календарный год.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.) и по ст. 4.1.1 КоАП РФ (предупреждение).
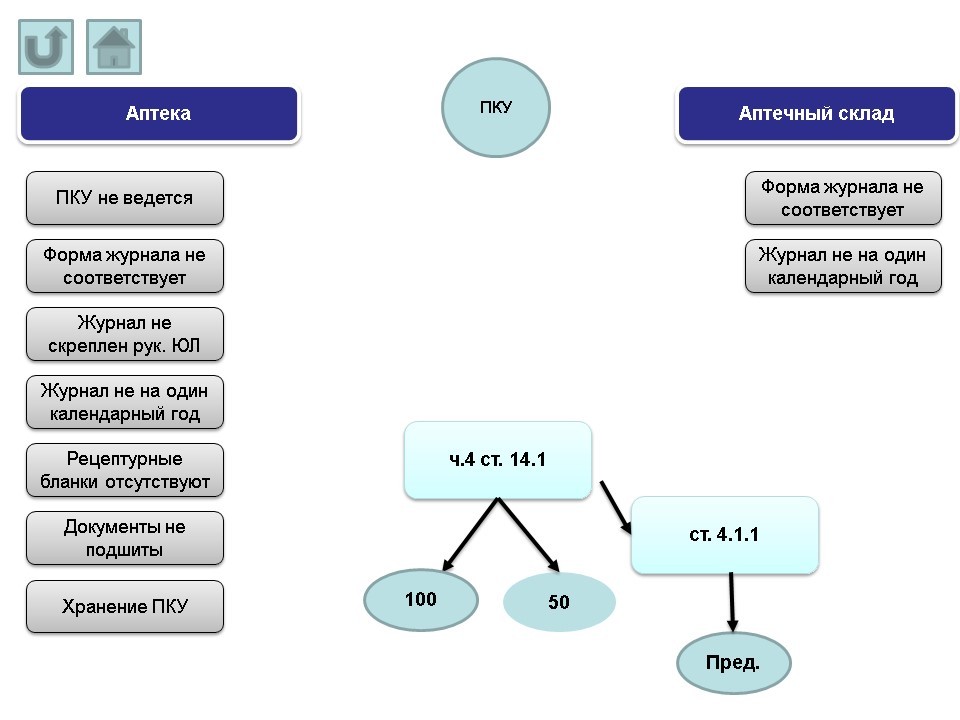
VI. Отпуск лекарственных препаратов
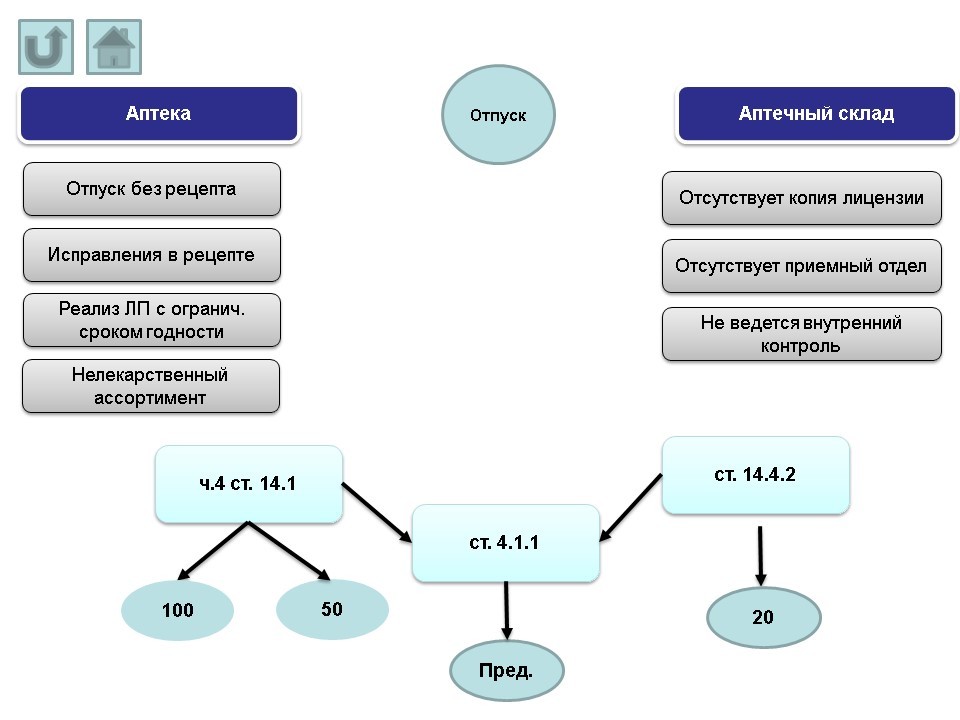
Основные нарушения, допускаемые аптеками:
- отпуск лекарственного препарата без рецепта.
Пример.
В нарушение п. 4 Правил отпуска лекарственных средств, утвержденных Приказом Министерства здравоохранения Российской Федерации от 11.07.2017 №403н, в ходе проверки 25.09.2017 в аптеке МУП «…» зафиксирован факт отпуска лекарственного препарата посетителю аптеки, отпускаемого по рецепту врача, без предъявления рецепта:
- Нолипрел А би-форте 10мг+2,5мг № 30 таблеток, на вторичной упаковке и инструкции по применению «Условия отпуска: по рецепту» - 1 упаковка.
Факт отпуска вышеназванного лекарственного препарата подтверждается копией кассового чека № 0850 от 25.09.2017, товарным чеком к чеку № 850 от 25.09.2017.
- исправления в рецепте.
Пример.
В нарушение п. 15 приказа № 403н, п. 3 и п. 15 Порядка оформления рецептурных бланков на лекарственные препараты, их учета и хранения, утвержденных приказом Министерства здравоохранения Российской Федерации от 20.12.2012 № 1175н в ходе проверки 25.09.2017, комиссией в аптеке зафиксированы факты отпуска лекарственных препаратов посетителям аптеки по неправильно выписанным рецептам, которые не были возвращены пациентам и не зарегистрированы в специальном журнале:
- реализация лекарственных препаратов с ограниченным сроком годности.
Пример.
В ходе внеплановой выездной проверки ООО «…» выявлены нарушения порядка розничной торговли лекарственными препаратами, а именно:
установлен факт реализации 24.04.2017 лекарственного препарата Ко-диротон 10мг+12,5мг № 30 таб. серии Н45072A со сроком годности до 01.05.2017 (нарушение п.24 Правил продажи отдельных видов утвержденных постановлением Правительства Российской Федерации от 19.01.1998 № 55).
Согласно инструкции по медицинскому применению лекарственный препарат "Ко-диротон" принимается в дозе по 1 таблетке 1 раз в сутки, доза может быть увеличена до 2 таблеток в сутки.
Таким образом, суд соглашается с позицией административного органа, что в период с 24.04.2017 по 01.05.2017 (за 7 дней) 1 упаковка лекарственного препарата Ко-диротон 10мг+12,5мг № 30 таб. не могла быть полностью использована пациентом.
Доводы ООО «…» о том, что препарат может быть приобретен для совместного использования с другими лицами несостоятельны, так как данный лекарственный препарат отпускается по рецепту врача, выписанному конкретному пациенту, и при отпуске лекарственного препарата по рецепту сотрудники аптеки не могут учитывать возможность его применения группой лиц.
- нелекарственный ассортимент.
Пример 1.
Нарушен п. 7, статьи 55 Федерального закона от 12.04.2010 года № 61-ФЗ «Об обращении лекарственных средств» в части реализации товара, не включенного в ассортимент, разрешенный к реализации из аптечной организации.
На момент проверки в аптечной организации на витрине совместно с лекарственными препаратами находились: «Марс с нугой и карамелью», в количестве 1-го батончика; «Марс Макс с нугой и карамелью», в количестве 1- го батончика; «Сникерс с жареным арахисом, карамелью и нугой», в количестве 2-х батончиков; Печенье песочное «Твикс Экстра белый шоколад с карамелью, покрытое белым шоколадом», в количестве 1-го батончика.
Вся вышеперечисленная продукция была поставлена ООО «…» в аптечную организацию согласно расходной накладной.
Аптечной организацией были представлены документы таможенного союза декларации о соответствии, согласно которым «Марс с нугой и карамелью», «Марс Макс с нугой и карамелью», «Сникерс с жареным арахисом, карамелью и нугой» имеют код ТН ВЭД 1806310000, в котором указано, что данная продукция относится к разделу IV «Готовые пищевые продукты», «Шоколад и прочие готовые пищевые продукты, содержащие какао».
Печенье песочное «Твикс Экстра белый шоколад с карамелью, покрытое белым шоколадом» имеет код ТН ВЭД ТС: 1905311900, в котором указано, что данная продукция относится к разделу IV «Готовые пищевые продукты» «Сладкое сухое печенье, полностью или частично покрытое шоколадом и другими изделиями содержащими какао».
Таким образом данная продукция не относится к продукции, разрешенной к реализации из аптечных организаций, а следовательно, не может, согласно требованиям действующего законодательства находится в обращении в аптечном учреждении.
Пример 2.
В нарушение части 7 статьи 55 Закона № 61-ФЗ допущена реализация товаров:
Пример 3.
По поступлении информации о выявлении в торговом зале аптечного пункта ООО «…», товаров, не включенных в ассортимент, разрешенный к реализации аптечными организациями, административным органом проведена проверка, в ходе которой было установлено, что в аптечном пункте в витрине покупателям представлены:
- игрушка-брызгалка д/ванной (набор) Баю-бай, Курносики, артикул 25130, Китай (1 упак.);
- игрушка для ванной (набор) Уточки, Курносики, артикул 25039, Китай (1 набор);
- игрушка-брызгалка Веселая игра (набор), Курносики, артикул 25131, Китай (1 набор);
- игрушка для ванной Семейка дельфинов, Курносики, артикул 25075, Китай (2 упак.);
- игрушка-пирамидка Веселая радуга, Курносики, артикул 27136, КНР (2 упак.);
- погремушка Ловись рыбка с колеч., Курносики, артикул 21371, Китай (2 шт.);
- вентилятор настольный LS 1806-20, Китай (1 шт.), предназначенные для реализации населению (выставлены в витрину аптечного пункта и указанием розничных цен), что является нарушением установленного порядка розничной торговли лекарственными препаратами.
Судом установлено и материалами дела подтверждается, что заявитель в нарушение установленных правил приобрел, сформировал цену и выставил в витрину для последующей продажи населению товары, поименованные в акте проверки, протоколе об административном правонарушении и оспариваемом постановлении, которые не относятся к изделиям медицинского назначения, не являются предметами и средствами, предназначенными для ухода за новорожденными и детьми, не достигшими возраста трех лет.
Основные нарушения, допускаемые аптечными складами:
- отсутствие копии лицензии.
ООО «…» осуществляет оптовую торговлю на основании лицензии на осуществление фармацевтической деятельности, копия которой отсутствует и не размещена в удобном для ознакомления месте.
- отсутствие приемного отдела.
В нарушение пункта 9 Правил оптовой торговли в штатном расписании не предусмотрен приемный отдел, отсутствует штатная единица руководителя приемного отдела.
- не ведется внутренний контроль.
В нарушение п. 14 Правил оптовой торговли лекарственными средствами для медицинского применения, утвержденных приказом министерства здравоохранения и социального развития Российской Федерации от 28.12.2010 №1222н. На момент проведения проверки установлено, что внутренний контроль за соблюдением Правил оптовой торговли лекарственными средствами не организован.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.) и по ст. 4.1.1 КоАП РФ (предупреждение). Если нарушение было допущено только по порядку оптовой или розничной торговли, протокол будет составлен по ст.14.4.2 (штраф на юридическое лицо от 20 т.р.).
Пример.
Из материалов дела не усматривается, что ранее Общество привлекалось к ответственности за совершение административного правонарушения, предусмотренного части 1 статьи 14.4.2 КоАП.
ООО «…» внесено в единый реестр субъектов малого и среднего предпринимательства (категория «малое предприятие»), имеет незначительный доход от указанного вида деятельности.
Учитывая, что правонарушение обществом совершено впервые, отсутствует злостный умысел на его совершение, общество имеет незначительный доход от рассматриваемого вида деятельности, суд считает возможным применить к конкретному субъекту меру административной ответственности в виде предупреждения.
Однако судом не может быть применена часть 1 статьи 4.1.1 Кодекса Российской Федерации об административных правонарушениях ввиду того, что совершенное правонарушение может повлечь вред жизни и здоровью граждан, так как деятельность общества связана с реализацией лекарственных препаратов.
Рассмотрев материалы проверки, административный орган вынес постановление по делу об административном правонарушении от 14.04.2017, которым общество признано виновным в совершении административного правонарушения, предусмотренного частью 1 статьи 14.4.2 Кодекса Российской Федерации об административных правонарушениях, и привлечено к административной ответственности в виде штрафа в размере 20 000 рублей.
- отпуск лекарственного препарата без рецепта.
Пример.
В нарушение п. 4 Правил отпуска лекарственных средств, утвержденных Приказом Министерства здравоохранения Российской Федерации от 11.07.2017 №403н, в ходе проверки 25.09.2017 в аптеке МУП «…» зафиксирован факт отпуска лекарственного препарата посетителю аптеки, отпускаемого по рецепту врача, без предъявления рецепта:
- Нолипрел А би-форте 10мг+2,5мг № 30 таблеток, на вторичной упаковке и инструкции по применению «Условия отпуска: по рецепту» - 1 упаковка.
Факт отпуска вышеназванного лекарственного препарата подтверждается копией кассового чека № 0850 от 25.09.2017, товарным чеком к чеку № 850 от 25.09.2017.
- исправления в рецепте.
Пример.
В нарушение п. 15 приказа № 403н, п. 3 и п. 15 Порядка оформления рецептурных бланков на лекарственные препараты, их учета и хранения, утвержденных приказом Министерства здравоохранения Российской Федерации от 20.12.2012 № 1175н в ходе проверки 25.09.2017, комиссией в аптеке зафиксированы факты отпуска лекарственных препаратов посетителям аптеки по неправильно выписанным рецептам, которые не были возвращены пациентам и не зарегистрированы в специальном журнале:
- рецепт серия 86 № 051885697 (исправлен код категории граждан);
- рецепт серия 86АА №1587575 (исправлен номер рецепта);
- рецепт серия 86АА № 1588207 (исправлен номер рецепта);
- рецепт серия 86АА № 1588344 (исправлен номер рецепта);
- рецепт серия 86 № 05198982 (исправлена дата выписки рецепта);
- рецепт серия 86 № 05203333 (исправлен код лекарственного средства);
- рецепт серия 86 № 0197533 (запись о коде лекарственного средства сделана карандашом).
- реализация лекарственных препаратов с ограниченным сроком годности.
Пример.
В ходе внеплановой выездной проверки ООО «…» выявлены нарушения порядка розничной торговли лекарственными препаратами, а именно:
установлен факт реализации 24.04.2017 лекарственного препарата Ко-диротон 10мг+12,5мг № 30 таб. серии Н45072A со сроком годности до 01.05.2017 (нарушение п.24 Правил продажи отдельных видов утвержденных постановлением Правительства Российской Федерации от 19.01.1998 № 55).
Согласно инструкции по медицинскому применению лекарственный препарат "Ко-диротон" принимается в дозе по 1 таблетке 1 раз в сутки, доза может быть увеличена до 2 таблеток в сутки.
Таким образом, суд соглашается с позицией административного органа, что в период с 24.04.2017 по 01.05.2017 (за 7 дней) 1 упаковка лекарственного препарата Ко-диротон 10мг+12,5мг № 30 таб. не могла быть полностью использована пациентом.
Доводы ООО «…» о том, что препарат может быть приобретен для совместного использования с другими лицами несостоятельны, так как данный лекарственный препарат отпускается по рецепту врача, выписанному конкретному пациенту, и при отпуске лекарственного препарата по рецепту сотрудники аптеки не могут учитывать возможность его применения группой лиц.
- нелекарственный ассортимент.
Пример 1.
Нарушен п. 7, статьи 55 Федерального закона от 12.04.2010 года № 61-ФЗ «Об обращении лекарственных средств» в части реализации товара, не включенного в ассортимент, разрешенный к реализации из аптечной организации.
На момент проверки в аптечной организации на витрине совместно с лекарственными препаратами находились: «Марс с нугой и карамелью», в количестве 1-го батончика; «Марс Макс с нугой и карамелью», в количестве 1- го батончика; «Сникерс с жареным арахисом, карамелью и нугой», в количестве 2-х батончиков; Печенье песочное «Твикс Экстра белый шоколад с карамелью, покрытое белым шоколадом», в количестве 1-го батончика.
Вся вышеперечисленная продукция была поставлена ООО «…» в аптечную организацию согласно расходной накладной.
Аптечной организацией были представлены документы таможенного союза декларации о соответствии, согласно которым «Марс с нугой и карамелью», «Марс Макс с нугой и карамелью», «Сникерс с жареным арахисом, карамелью и нугой» имеют код ТН ВЭД 1806310000, в котором указано, что данная продукция относится к разделу IV «Готовые пищевые продукты», «Шоколад и прочие готовые пищевые продукты, содержащие какао».
Печенье песочное «Твикс Экстра белый шоколад с карамелью, покрытое белым шоколадом» имеет код ТН ВЭД ТС: 1905311900, в котором указано, что данная продукция относится к разделу IV «Готовые пищевые продукты» «Сладкое сухое печенье, полностью или частично покрытое шоколадом и другими изделиями содержащими какао».
Таким образом данная продукция не относится к продукции, разрешенной к реализации из аптечных организаций, а следовательно, не может, согласно требованиям действующего законодательства находится в обращении в аптечном учреждении.
Пример 2.
В нарушение части 7 статьи 55 Закона № 61-ФЗ допущена реализация товаров:
- «Фру-фру» жевательный мармелад с витаминами, товарная накладная от 19.05.2017г №Н-315871, в соответствии с кодом ОКП (общероссийский классификатор продукции) 91 2890: «Продукция пищевой промышленности», «Мармелад и пастельные изделия другие», в количестве 15 уп.;
- масло льняное нерафинированное пищевое, объем 0,5 л., в количестве 1 шт, в соответствии с кодом ТН ВЭД (торговая номенклатура внешнеэкономической деятельности): 1515 - «Жиры, масла животного или растительного происхождения, готовые пищевые жиры»;
- булавки безопасные, в количестве 1 уп, в соответствии с кодом ОКП (общероссийский классификатор продукции): 22 9310 «Изделия хозяйственного обихода из пластмасс»;
- леденцы «БОБС» со вкусом и ароматом малинового чая с витамином С, в количестве 4 уп., в соответствии с кодом кодом ОКП (общероссийский классификатор продукции) 91 2110: «Продукция пищевой промышленности» «Карамель леденцовая»;
- мыло хозяйственное твердое детское «Ушастый нянь» с отбеливающим эффектом, в количестве 5 уп. в соответствии с кодом ОКП (общероссийский классификатор продукции): 91 4411 «Мыло хозяйственное твердое»;
Пример 3.
По поступлении информации о выявлении в торговом зале аптечного пункта ООО «…», товаров, не включенных в ассортимент, разрешенный к реализации аптечными организациями, административным органом проведена проверка, в ходе которой было установлено, что в аптечном пункте в витрине покупателям представлены:
- игрушка-брызгалка д/ванной (набор) Баю-бай, Курносики, артикул 25130, Китай (1 упак.);
- игрушка для ванной (набор) Уточки, Курносики, артикул 25039, Китай (1 набор);
- игрушка-брызгалка Веселая игра (набор), Курносики, артикул 25131, Китай (1 набор);
- игрушка для ванной Семейка дельфинов, Курносики, артикул 25075, Китай (2 упак.);
- игрушка-пирамидка Веселая радуга, Курносики, артикул 27136, КНР (2 упак.);
- погремушка Ловись рыбка с колеч., Курносики, артикул 21371, Китай (2 шт.);
- вентилятор настольный LS 1806-20, Китай (1 шт.), предназначенные для реализации населению (выставлены в витрину аптечного пункта и указанием розничных цен), что является нарушением установленного порядка розничной торговли лекарственными препаратами.
Судом установлено и материалами дела подтверждается, что заявитель в нарушение установленных правил приобрел, сформировал цену и выставил в витрину для последующей продажи населению товары, поименованные в акте проверки, протоколе об административном правонарушении и оспариваемом постановлении, которые не относятся к изделиям медицинского назначения, не являются предметами и средствами, предназначенными для ухода за новорожденными и детьми, не достигшими возраста трех лет.
Основные нарушения, допускаемые аптечными складами:
- отсутствие копии лицензии.
ООО «…» осуществляет оптовую торговлю на основании лицензии на осуществление фармацевтической деятельности, копия которой отсутствует и не размещена в удобном для ознакомления месте.
- отсутствие приемного отдела.
В нарушение пункта 9 Правил оптовой торговли в штатном расписании не предусмотрен приемный отдел, отсутствует штатная единица руководителя приемного отдела.
- не ведется внутренний контроль.
В нарушение п. 14 Правил оптовой торговли лекарственными средствами для медицинского применения, утвержденных приказом министерства здравоохранения и социального развития Российской Федерации от 28.12.2010 №1222н. На момент проведения проверки установлено, что внутренний контроль за соблюдением Правил оптовой торговли лекарственными средствами не организован.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.) и по ст. 4.1.1 КоАП РФ (предупреждение). Если нарушение было допущено только по порядку оптовой или розничной торговли, протокол будет составлен по ст.14.4.2 (штраф на юридическое лицо от 20 т.р.).
Пример.
Из материалов дела не усматривается, что ранее Общество привлекалось к ответственности за совершение административного правонарушения, предусмотренного части 1 статьи 14.4.2 КоАП.
ООО «…» внесено в единый реестр субъектов малого и среднего предпринимательства (категория «малое предприятие»), имеет незначительный доход от указанного вида деятельности.
Учитывая, что правонарушение обществом совершено впервые, отсутствует злостный умысел на его совершение, общество имеет незначительный доход от рассматриваемого вида деятельности, суд считает возможным применить к конкретному субъекту меру административной ответственности в виде предупреждения.
Однако судом не может быть применена часть 1 статьи 4.1.1 Кодекса Российской Федерации об административных правонарушениях ввиду того, что совершенное правонарушение может повлечь вред жизни и здоровью граждан, так как деятельность общества связана с реализацией лекарственных препаратов.
Рассмотрев материалы проверки, административный орган вынес постановление по делу об административном правонарушении от 14.04.2017, которым общество признано виновным в совершении административного правонарушения, предусмотренного частью 1 статьи 14.4.2 Кодекса Российской Федерации об административных правонарушениях, и привлечено к административной ответственности в виде штрафа в размере 20 000 рублей.
VII. Образование специалистов
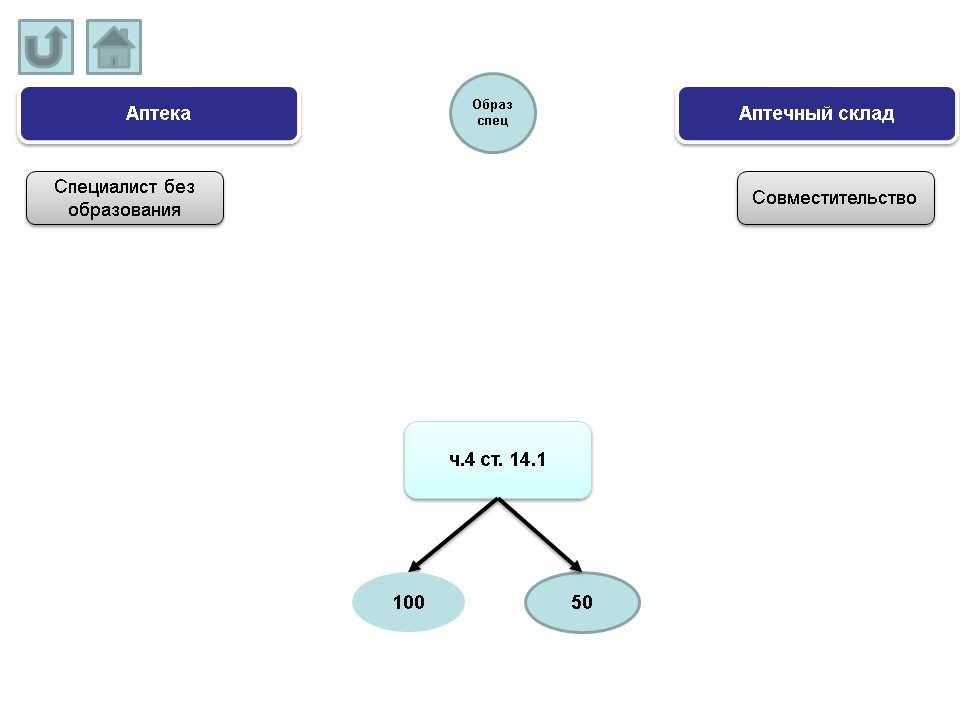
Основные нарушения, допускаемые аптеками:
- специалист без образования.
Пример 1.
В табеле учета рабочего времени указан маркировщик У., сведения об образовании отсутствуют. Приказ № 48-л/с от 06.11.2015 и должностная инструкция продавца-консультанта аптеки от 06.11.2015 на данного работника, подписаны им и ООО «…». При этом в аптеке отсутствуют условия для деятельности продавца-консультанта, что подтверждается фотоматериалом аптеки и торгового зала.
ООО «…» допустило к деятельности по отпуску лекарственных препаратов, в том числе подлежащих предметно-количественному учету, сотрудника, не имеющего соответствующего образования и подготовки; данный факт подтверждается согласно табелю учета рабочего времени в период 13.03.2017 и 14.03.2017 его подписями на рецептах об отпуске лекарственных препаратов, подлежащих предметно-количественному учету «Небидо», «Мидриацил», а также 12.03.2017 «Небидо», в тот день, когда он не отмечен в качестве маркировщика.
Кроме того, фактически 23.03.2017 осуществлял деятельность по приемке и отпуску лекарственных препаратов сотрудник, который не имеет специального фармацевтического образования и сертификата специалиста, представлен в штатном расписании и графике учета рабочего времени как оператор ПК (диплом менеджера СПб ГБОУ ВПО СПЮ гос. Электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина), что подтверждается фотоматериалом.
Вместе с приказом № 173-л/с от 05.10.2011 и должностной инструкцией оператора, ООО «…» приказом № 10-л/с от 30.10.2015 назначило данного сотрудника заместителем заведующей аптекой и тем самым допустило его без специального образования и подготовки к деятельности, связанной с приемкой, хранением и отпуском лекарственных препаратов, что подтверждается подписями в должностной инструкции от 30.10.2015 и записями в его трудовой книжке, отметкой в чеке заявительницы, а также фотоматериалом.
В связи с этим, отсутствует надлежащий контроль за отпуском лекарственных препаратов, подлежащих предметно-количественному учету.
Пример 2.
В аптечном пункте ООО «…» осуществляла розничную торговлю лекарственными препаратами, в том числе препаратами, подлежащими отпуску по рецептам врачей, гр. В, не имеющая высшего или среднего фармацевтического образования и сертификата специалиста (подтверждается кассовыми чеками, от 15.07.2017, в которых гр. В указана в качестве фармацевта).
Режим работы аптечного пункта ежедневно с 8-00 до 22-00 без перерыва на обед. В соответствии с установленным режимом рабочее время аптечного пункта составляет 14 часов ежедневно. 15 июля 2017 года в аптечном пункте, в соответствии с представленным табелем почасового учета рабочего времени на предприятии ООО «…», работали: фармацевт С. - 12 часов, кассир В. - 12 часов, администратор торгового зала И. - 13 часов. Следовательно, гр. В. в течении 2 часов работала в аптечном пункте без сотрудника, имеющего фармацевтическое образование.
В отзыве на заявленные требования ООО «…» просит суд отказать в привлечении к административной ответственности по следующим основаниям.
Доводы ООО «…» о том, что информация о гр. В. как о фармацевте была внесена в программное обеспечение ККТ ошибочно, данные табеля учёта рабочего времени за июль 2017 года содержат ошибочную информацию, отклоняются судом, как не подтверждённые соответствующими доказательствами.
Суд приходит к выводу о наличии в действиях ООО «…» состава административного правонарушения, предусмотренного частью 4 статьи 14.1 КоАП РФ.
Вместе с тем, суд приходит к выводу, что осуществление лицом, не имеющим специального образования и сертификата специалиста, розничной торговли лекарственными препаратами, в том числе лекарственными препаратами, подлежащими отпуску по рецептам врачей, влечёт непосредственную угрозу причинения вреда здоровью людей.
Таким образом, в рассматриваемом случае административное наказание в виде предупреждения к ООО «…» не может быть применено.
Поскольку отягчающие ответственность обстоятельства, предусмотренные статьей 4.3 КоАП РФ, судом не установлены, ООО «…» за совершение подобного правонарушения привлекается впервые, а также с учетом незначительного периода работы гр. В. в аптечном пункте ООО «…» (с 14 по 19 июля 2017 года) суд приходит к выводу о возможности в данном случае назначения ООО «…» наказания в размере ниже низшего предела, предусмотренного санкцией части 4 статьи 14.1 Кодекса РФ об административных правонарушениях, что составляет 50 000 руб.
Основные нарушения, допускаемые аптечными складами:
- совместительтво.
Пример.
Суд усматривает нарушение лицензионных требований у ООО «…», которое выразилось в отсутствии необходимого количества персонала. Все специалисты ООО «…» помимо исполнения трудовых обязанностей при 8 часовом рабочем дней, работают по совместительству по 4 часа в другой организации при совпадающем графике работы в обеих организациях.
Указанное обстоятельство свидетельствует о нарушении требований п.7 Правил №646н.
Для соблюдения установленных настоящими Правилами требований субъект обращения лекарственных препаратов с учетом объема осуществляемой им деятельности по хранению и (или) перевозке лекарственных препаратов должен иметь необходимый персонал.
- специалист без образования.
Пример 1.
В табеле учета рабочего времени указан маркировщик У., сведения об образовании отсутствуют. Приказ № 48-л/с от 06.11.2015 и должностная инструкция продавца-консультанта аптеки от 06.11.2015 на данного работника, подписаны им и ООО «…». При этом в аптеке отсутствуют условия для деятельности продавца-консультанта, что подтверждается фотоматериалом аптеки и торгового зала.
ООО «…» допустило к деятельности по отпуску лекарственных препаратов, в том числе подлежащих предметно-количественному учету, сотрудника, не имеющего соответствующего образования и подготовки; данный факт подтверждается согласно табелю учета рабочего времени в период 13.03.2017 и 14.03.2017 его подписями на рецептах об отпуске лекарственных препаратов, подлежащих предметно-количественному учету «Небидо», «Мидриацил», а также 12.03.2017 «Небидо», в тот день, когда он не отмечен в качестве маркировщика.
Кроме того, фактически 23.03.2017 осуществлял деятельность по приемке и отпуску лекарственных препаратов сотрудник, который не имеет специального фармацевтического образования и сертификата специалиста, представлен в штатном расписании и графике учета рабочего времени как оператор ПК (диплом менеджера СПб ГБОУ ВПО СПЮ гос. Электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина), что подтверждается фотоматериалом.
Вместе с приказом № 173-л/с от 05.10.2011 и должностной инструкцией оператора, ООО «…» приказом № 10-л/с от 30.10.2015 назначило данного сотрудника заместителем заведующей аптекой и тем самым допустило его без специального образования и подготовки к деятельности, связанной с приемкой, хранением и отпуском лекарственных препаратов, что подтверждается подписями в должностной инструкции от 30.10.2015 и записями в его трудовой книжке, отметкой в чеке заявительницы, а также фотоматериалом.
В связи с этим, отсутствует надлежащий контроль за отпуском лекарственных препаратов, подлежащих предметно-количественному учету.
Пример 2.
В аптечном пункте ООО «…» осуществляла розничную торговлю лекарственными препаратами, в том числе препаратами, подлежащими отпуску по рецептам врачей, гр. В, не имеющая высшего или среднего фармацевтического образования и сертификата специалиста (подтверждается кассовыми чеками, от 15.07.2017, в которых гр. В указана в качестве фармацевта).
Режим работы аптечного пункта ежедневно с 8-00 до 22-00 без перерыва на обед. В соответствии с установленным режимом рабочее время аптечного пункта составляет 14 часов ежедневно. 15 июля 2017 года в аптечном пункте, в соответствии с представленным табелем почасового учета рабочего времени на предприятии ООО «…», работали: фармацевт С. - 12 часов, кассир В. - 12 часов, администратор торгового зала И. - 13 часов. Следовательно, гр. В. в течении 2 часов работала в аптечном пункте без сотрудника, имеющего фармацевтическое образование.
В отзыве на заявленные требования ООО «…» просит суд отказать в привлечении к административной ответственности по следующим основаниям.
- информация о том, что гр. В. является фармацевтом была внесена в программное обеспечение ККТ ошибочно,
- в период с 8.00 до 22.00 в аптеке присутствовала фармацевт С,
- данные табеля учёта рабочего времени за июль 2017 года содержат ошибочную информацию.
Доводы ООО «…» о том, что информация о гр. В. как о фармацевте была внесена в программное обеспечение ККТ ошибочно, данные табеля учёта рабочего времени за июль 2017 года содержат ошибочную информацию, отклоняются судом, как не подтверждённые соответствующими доказательствами.
Суд приходит к выводу о наличии в действиях ООО «…» состава административного правонарушения, предусмотренного частью 4 статьи 14.1 КоАП РФ.
Вместе с тем, суд приходит к выводу, что осуществление лицом, не имеющим специального образования и сертификата специалиста, розничной торговли лекарственными препаратами, в том числе лекарственными препаратами, подлежащими отпуску по рецептам врачей, влечёт непосредственную угрозу причинения вреда здоровью людей.
Таким образом, в рассматриваемом случае административное наказание в виде предупреждения к ООО «…» не может быть применено.
Поскольку отягчающие ответственность обстоятельства, предусмотренные статьей 4.3 КоАП РФ, судом не установлены, ООО «…» за совершение подобного правонарушения привлекается впервые, а также с учетом незначительного периода работы гр. В. в аптечном пункте ООО «…» (с 14 по 19 июля 2017 года) суд приходит к выводу о возможности в данном случае назначения ООО «…» наказания в размере ниже низшего предела, предусмотренного санкцией части 4 статьи 14.1 Кодекса РФ об административных правонарушениях, что составляет 50 000 руб.
Основные нарушения, допускаемые аптечными складами:
- совместительтво.
Пример.
Суд усматривает нарушение лицензионных требований у ООО «…», которое выразилось в отсутствии необходимого количества персонала. Все специалисты ООО «…» помимо исполнения трудовых обязанностей при 8 часовом рабочем дней, работают по совместительству по 4 часа в другой организации при совпадающем графике работы в обеих организациях.
Указанное обстоятельство свидетельствует о нарушении требований п.7 Правил №646н.
Для соблюдения установленных настоящими Правилами требований субъект обращения лекарственных препаратов с учетом объема осуществляемой им деятельности по хранению и (или) перевозке лекарственных препаратов должен иметь необходимый персонал.
VIII. Контроль качества лекарственных препаратов и медицинских изделий
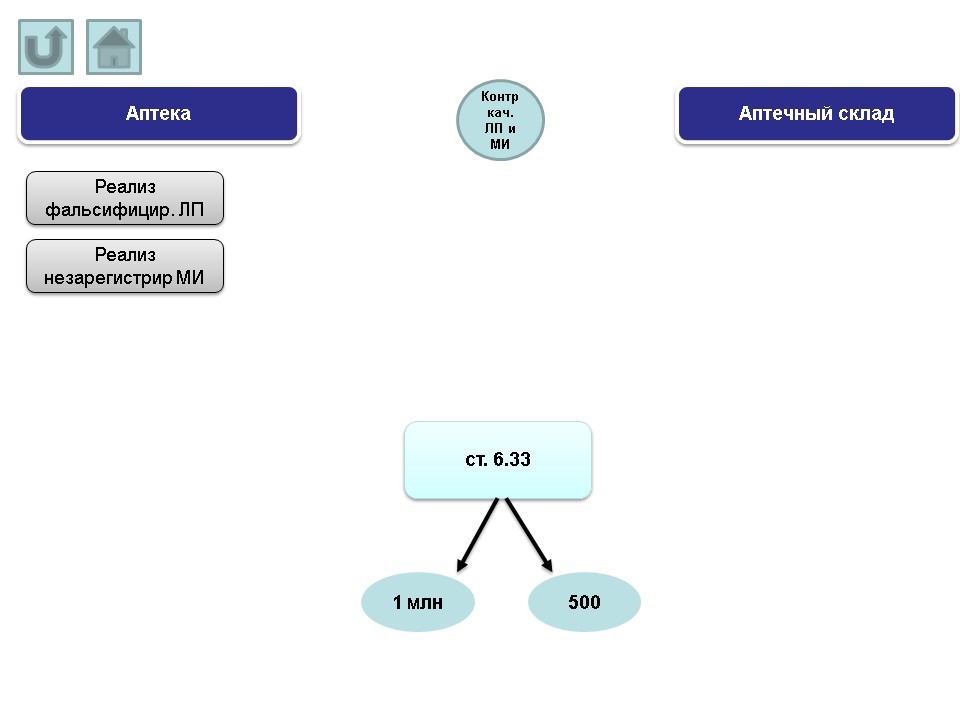
Основные нарушения, допускаемые аптеками:
- реализация фальсифицированных лекарственных препаратов.
Пример.
26 мая 2017 осуществлен выезд в ООО «…». В ходе осмотра места осуществления деятельности в шкафу белого цвета материальной комнаты аптечного пункта в общем месте хранения совместно с другими лекарственными препаратами хранился «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307, в количестве 1 упаковки.
Информационным письмом Федеральной службы по надзору в сфере здравоохранения от 11.03.2016г. №02и-499/16 «О необходимости изъятия из обращения фальсифицированного лекарственного препарата» субъекты обращения лекарственных средств были проинформированы о необходимости изъятия из обращения фальсифицированного лекарственного препарата «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307.
На основании обнаружения указанных признаков фальсификации был произведён арест данной упаковки лекарственного препарата и изъятие. После чего была организована и проведена экспертиза качества лекарственного препарата: «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307.
В представленном протоколе сравнения испытуемый образец «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307 имеет все признаки фальсифицированного препарата, описанные в приложении к письму Росздравнадзора от 11.03.2016 №02И-499/16, не выдерживает испытания по показателям: «Описание», «Подлинность», «Количественное определение» (в указанном лекарственном препарате отсутствует действующее вещество).
Заключение эксперта: «Лекарственный препарат, не имеющий в своем составе основного действующего компонента может причинить тяжкий вред здоровью пациента, вплоть до смертельного исхода, так как в процессе лечения не наступит ожидаемый терапевтический эффект».
- реализация незарегистрированных медицинских изделий.
Пример.
В торговом зале аптеки, в шкафу для хранения фармацевтической продукции находилось медицинское изделие «пластырь-компресс перцовый extraplast» производства СИНСИН Фармасьютикал Ко.,Лтд, Корея, в количестве 52 шт.
Название обнаруженного на реализации медицинского изделия не соответствует названию, указанному в Регистрационном удостоверении № ФСЗ 2007/00450 от 06.11.2007.
Согласно товарной накладной от 20.08.2014 № 1919 данное медицинское изделие было поставлено в адрес ИП ... поставщиком ООО «…». В товарной накладной значится – пластырь Экстрапласт перцовый 94*124 мм в количестве 600 шт. на общую сумму 12609,60 руб.
В ходе проверки и осмотра представлено регистрационное удостоверение № ФСЗ 2007/00450 от 06.11.2007 (без ограничения срока) согласно которому изделие медицинского назначения Лейкопластырь медицинский перцовый extraplast разрешено к импорту, продаже и применению на территории Российской Федерации.
Вместе с тем, письмом Федеральной службы по надзору в сфере здравоохранения от 03.12.2015 № 014-2061/15 до субъектов обращения медицинских изделий доведено, что медицинское изделие «Пластырь-компресс перцовый extraplast» является незарегистрированным, и на него не распространяется действие регистрационного удостоверения № ФСЗ 2007/00450 от 06.11.2007 (без ограничения срока). Субъектам обращения медицинских изделий предложено провести мероприятия по предотвращению обращения на территории Российской Федерации медицинского изделия, несоответствующего обязательным требованиям.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ст. 6.33 КоАП РФ (штраф от 1 млн.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 500 т.р.).
- реализация фальсифицированных лекарственных препаратов.
Пример.
26 мая 2017 осуществлен выезд в ООО «…». В ходе осмотра места осуществления деятельности в шкафу белого цвета материальной комнаты аптечного пункта в общем месте хранения совместно с другими лекарственными препаратами хранился «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307, в количестве 1 упаковки.
Информационным письмом Федеральной службы по надзору в сфере здравоохранения от 11.03.2016г. №02и-499/16 «О необходимости изъятия из обращения фальсифицированного лекарственного препарата» субъекты обращения лекарственных средств были проинформированы о необходимости изъятия из обращения фальсифицированного лекарственного препарата «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307.
На основании обнаружения указанных признаков фальсификации был произведён арест данной упаковки лекарственного препарата и изъятие. После чего была организована и проведена экспертиза качества лекарственного препарата: «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307.
В представленном протоколе сравнения испытуемый образец «Кетостерил»® таблетки, покрытые пленочной оболочкой № 100, упаковки ячейковые контурные, пачки картонные», серии 18Н2307 имеет все признаки фальсифицированного препарата, описанные в приложении к письму Росздравнадзора от 11.03.2016 №02И-499/16, не выдерживает испытания по показателям: «Описание», «Подлинность», «Количественное определение» (в указанном лекарственном препарате отсутствует действующее вещество).
Заключение эксперта: «Лекарственный препарат, не имеющий в своем составе основного действующего компонента может причинить тяжкий вред здоровью пациента, вплоть до смертельного исхода, так как в процессе лечения не наступит ожидаемый терапевтический эффект».
- реализация незарегистрированных медицинских изделий.
Пример.
В торговом зале аптеки, в шкафу для хранения фармацевтической продукции находилось медицинское изделие «пластырь-компресс перцовый extraplast» производства СИНСИН Фармасьютикал Ко.,Лтд, Корея, в количестве 52 шт.
Название обнаруженного на реализации медицинского изделия не соответствует названию, указанному в Регистрационном удостоверении № ФСЗ 2007/00450 от 06.11.2007.
Согласно товарной накладной от 20.08.2014 № 1919 данное медицинское изделие было поставлено в адрес ИП ... поставщиком ООО «…». В товарной накладной значится – пластырь Экстрапласт перцовый 94*124 мм в количестве 600 шт. на общую сумму 12609,60 руб.
В ходе проверки и осмотра представлено регистрационное удостоверение № ФСЗ 2007/00450 от 06.11.2007 (без ограничения срока) согласно которому изделие медицинского назначения Лейкопластырь медицинский перцовый extraplast разрешено к импорту, продаже и применению на территории Российской Федерации.
Вместе с тем, письмом Федеральной службы по надзору в сфере здравоохранения от 03.12.2015 № 014-2061/15 до субъектов обращения медицинских изделий доведено, что медицинское изделие «Пластырь-компресс перцовый extraplast» является незарегистрированным, и на него не распространяется действие регистрационного удостоверения № ФСЗ 2007/00450 от 06.11.2007 (без ограничения срока). Субъектам обращения медицинских изделий предложено провести мероприятия по предотвращению обращения на территории Российской Федерации медицинского изделия, несоответствующего обязательным требованиям.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ст. 6.33 КоАП РФ (штраф от 1 млн.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 500 т.р.).
IX. Изготовление лекарственных препаратов.
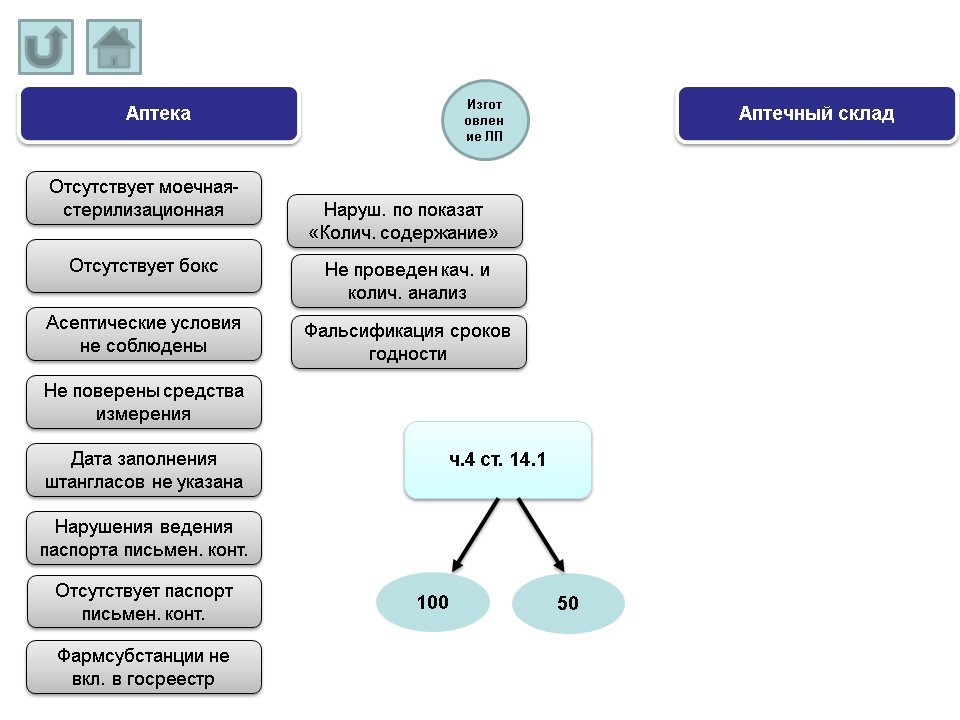
Основные нарушения, допускаемые аптеками:
- отсутствует моечная-стерилизационная.
Пример.
В нарушение требований Приказа Минздрава РФ от 21.10.1997 № 309 "Об утверждении Инструкции по санитарному режиму аптечных организаций (аптек)" (приложение 2) в ООО «…» отсутствует:
- отсутствует бокс.
Пример.
Бокс отсутствует.
Вместе с тем аптека готовит концентрат 50% раствора кальция хлорида 2 л., который в соответствии с требованиями п. 36 Приказом Министерства здравоохранения РФ от 26.10.2015 г. N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность" концентрированные растворы изготавливаются массо-объемным методом в мерной посуде в асептических условиях с использованием свежеполученной очищенной воды, т.е. требуют специального помещения - асептического бокса.
- асептические условия не соблюдены.
Пример.
На момент проверки при выборочном опросе и проверке паспортов письменного контроля выявлено изготовление концентрата 50% раствора кальция хлорида 2 л. (ан. 384 от 06.03.17) в ассистентской на свежеполученной воде очищенной.
По приказу МЗ РФ № 751н от 26.10.2015 г. концентрированные растворы изготавливаются в асептических условиях и все записи производятся в журнале лабораторно-фасовочных работ (нарушением п. 36 - 50% раствора кальция хлорида должен готовиться в асептических условиях).
- не поверены средства измерения.
Пример.
В нарушение требований п.3.3 приказа Минздрава РФ от 16.07.1997 N 214 "О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)", п. 5 приказа Минздрава России от 26.10.2015 N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность", средства измерения (весы аптечные), используемые при изготовлении и контроле качества лекарственных препаратов, не поверены в установленном порядке.
- дата заполнения штангласов не указана.
Пример.
На штангласах с лекарственными средствами, находящимися в материальной комнате, не указана дата заполнения штангласов, на штангласах с лекарственными средствами, находящимися в ассистентской, не указаны дата окончания срока годности и дата заполнения штангласов.
Приказом Министерства здравоохранения Российской Федерации от 26 октября 2015 г. N 751н утверждены Правила изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, согласно приложению.
В соответствии с пунктом 6 Указанных Правил на всех банках или флаконах с притертой пробкой (далее - штанглас), в которых хранятся лекарственные средства, указываются наименование лекарственного средства, дата заполнения штангласа лекарственным средством, дата окончания срока годности (годен до ____), подпись лица, заполнившего штанглас и подтверждающего, что в штангласе содержится именно указанное лекарственное средство.
- нарушения ведения паспорта письменного контроля.
Пример.
В нарушение п. 120 приказа Минздрава России от 26.10.2015 N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность" в паспорте письменного контроля №2233, заполняемого при изготовлении препарата, отсутствует следующая информация:
Указанные нарушения подтверждаются копиями паспорта письменного контроля №2233.
- отсутствует паспорт письменного контроля.
Пример.
В нарушение п. 120 Приказа №751н, паспорт письменного контроля на лекарственный препарат «Антигриппин», анализ №915, серия №336, изготовленный 04.07.2017, по состоянию на 08.08.2017 в аптеке №147 отсутствует.
Согласно объяснительной провизора-аналитика аптеки №147, паспорт письменного контроля был оформлен неправильно, потому было принято решение его переписать, а старый уничтожить.
Паспорт письменного контроля заполняется сразу после изготовления лекарственного препарата, с указанием лекарственных средств на латинском языке, в соответствии с последовательностью технологических операций. Паспорта письменного контроля хранятся в течение двух месяцев со дня изготовления лекарственных препаратов.
- фармацевтические субстанции не включены в государственный реестр.
Пример.
В нарушение требований ч. 2 ст. 56 Федерального закона от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств", п. 3 приказа Минздрава России от 26.10.2015 N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность" аптекой при изготовлении используются субстанции сомнительного качества, так как в представленных документах на фармацевтические субстанции отсутствуют данные о внесение в государственный реестр, паспорта завода изготовителя:
1) «Атропа белла-донна (Беладонна), настойка матричная гомеопатическая, представлен протокол анализа № 673 от 25.09.2014 г.;
2) «Аконит аптечный, настойка матричная гомеопатическая», представлен протоколом анализа № 293 от 09.04.2014 г.
- нарушения по показателю «количественное содержание».
Пример.
В нарушение п. 12 Приказа Минздрава России от 26.10.2015 № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность», фармацевтом К., 04.07.2017 при изготовлении внутриаптечной заготовки «Порошок Антигриппина» (состава: димедрол 0,01; рутин 0,02; аскорбиновая кислота 0,15; кальция глюконат 0,1) в количестве 200 доз, допущено нарушение по показателю «Количественное содержание».
То есть допущена ошибка при смешивании ингредиентов, а именно: в ходе изготовления лекарственной формы, перепутана последовательность добавления и количество лекарственных субстанций: аскорбиновая кислота добавлена в количестве 2,0 г (вместо 30,0 г) и димедрол в количестве 30,0 г (вместо 2,0 г).
В то время как количество димедрола в одной дозе лекарственного препарата «Антигриппин» по прописи 0,01 г, а фактически составляет 0,155 г., т.е. дозировка лекарственного препарата димедрол в лекарственной форме «Антигриппин» завышена в 15,5 раз.
Согласно Государственной Фармакопее X издания - высшая разовая доза димедрола для детей 5 лет составляет 0,02 г. Фактическая доза в изготовленном лекарственном препарате - 0,155 г., что превышает высшую разовую дозу в 7,75 раз.
В соответствии с п. 12. Приказа №751н - измельчение и смешивание порошков осуществляется путем добавления последовательно ингредиентов от меньших количеств к большим количествам в предварительно затертой ступке индифферентным в фармакологическом отношении вспомогательным веществом или лекарственным средством с соблюдением потерь в соответствии с таблицей № 2 приложения № 2 к настоящим Правилам. Остальные ингредиенты при изготовлении порошков добавляются в порядке увеличения их массы при соблюдении соотношения 1:20.
- не проведен качественный и количественный анализ.
Пример.
В нарушение п. 134 Приказа №751н и п.3.7. Инструкции по контролю качества лекарственных средств, изготовляемых в аптечных организациях (аптеках), утвержденной приказом Минздрава РФ от 16.07.1997 №214, внутриаптечная заготовка, лекарственная форма «Антигриппин», на которую имеется методика анализа была изготовлена под наблюдением провизора-аналитика.
Качественный и количественный анализ внутриаптечной заготовки «Антигриппин» провизором-аналитиком аптеки не был проведен.
Кроме того, поскольку имеется методика количественного анализа «Антигриппина», то провизор-аналитик неправомерно сделала запись в Журнале регистрации химического контроля внутриаптечной заготовки за №915 от 04.07.2017, который фактически не проводила, что подтверждается ее объяснительной от 08.08.2017, и записью в журнале регистрации химического контроля внутриаптечной заготовки.
Таким образом, лекарственный препарат «Антигриппин» серия 336, анализ 915, изготовленный 04.07.2017 в количестве 20 упаковок, с нарушением технологии, не прошедший качественный и количественный анализ, поступил в продажу в количестве 20 упаковок и был реализован покупателям согласно выписке «История товара», представленной ГУП УР «АУ» в период с 06.07.2017 по 12.07.2017 в количестве 12 упаковок.
Лекарственная форма «Антигриппин является внутриаптечной заготовкой в силу массовости приобретения.
Согласно пп. «ж» п.134 Приказа №751н, качественному и количественному анализу (полный химический контроль) должны подвергаться в обязательном порядке лекарственные препараты в виде внутриаптечной заготовки каждой серии, кроме гомеопатических лекарственных препаратов.
- фальсификация сроков годности.
Пример.
В ходе проверки выявлено, что аптекой допускается фальсификация сроков годности на изготовленные в аптеке лекарственные препараты.
Так лекарственный препарат, «Антигриппин», анализ №915, серия №336, который согласно записей в Журнале регистрации химического контроля, в Журнале лабораторно-фасовочных работ и объяснительных фармацевта от 18.07.2017 и провизора-аналитика от 08.08.2017 - изготовлен и поступил в продажу 04.07.2017, (срок годности 10 дней, т.е. - до 14.07.2017)
Однако, этот же препарат продан с указанной датой изготовления 11.07.2017 (срок годности 10 дней, до 21.07.2017).
Согласно объяснительной провизора-аналитика, данной при проведении выездной проверки 08.08.2017 «дату (11.07.2017) на Антигриппин поставили утром в день отпуска, чтобы продлить срок годности лекарственной формы в летний период».
Таким образом, своими действиями аптека № 147 вводит в заблуждение потребителя о действительных сроках годности лекарственного препарата.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.).
- отсутствует моечная-стерилизационная.
Пример.
В нарушение требований Приказа Минздрава РФ от 21.10.1997 № 309 "Об утверждении Инструкции по санитарному режиму аптечных организаций (аптек)" (приложение 2) в ООО «…» отсутствует:
- моечная-стерилизационная (обработка рецептурной посуды; стерилизация посуды; подготовка укупорочных средств и вспомогательного материала);
- дистилляционная (получение дистиллированной воды (очищенной).
- отсутствует бокс.
Пример.
Бокс отсутствует.
Вместе с тем аптека готовит концентрат 50% раствора кальция хлорида 2 л., который в соответствии с требованиями п. 36 Приказом Министерства здравоохранения РФ от 26.10.2015 г. N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность" концентрированные растворы изготавливаются массо-объемным методом в мерной посуде в асептических условиях с использованием свежеполученной очищенной воды, т.е. требуют специального помещения - асептического бокса.
- асептические условия не соблюдены.
Пример.
На момент проверки при выборочном опросе и проверке паспортов письменного контроля выявлено изготовление концентрата 50% раствора кальция хлорида 2 л. (ан. 384 от 06.03.17) в ассистентской на свежеполученной воде очищенной.
По приказу МЗ РФ № 751н от 26.10.2015 г. концентрированные растворы изготавливаются в асептических условиях и все записи производятся в журнале лабораторно-фасовочных работ (нарушением п. 36 - 50% раствора кальция хлорида должен готовиться в асептических условиях).
- не поверены средства измерения.
Пример.
В нарушение требований п.3.3 приказа Минздрава РФ от 16.07.1997 N 214 "О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)", п. 5 приказа Минздрава России от 26.10.2015 N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность", средства измерения (весы аптечные), используемые при изготовлении и контроле качества лекарственных препаратов, не поверены в установленном порядке.
- дата заполнения штангласов не указана.
Пример.
На штангласах с лекарственными средствами, находящимися в материальной комнате, не указана дата заполнения штангласов, на штангласах с лекарственными средствами, находящимися в ассистентской, не указаны дата окончания срока годности и дата заполнения штангласов.
Приказом Министерства здравоохранения Российской Федерации от 26 октября 2015 г. N 751н утверждены Правила изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, согласно приложению.
В соответствии с пунктом 6 Указанных Правил на всех банках или флаконах с притертой пробкой (далее - штанглас), в которых хранятся лекарственные средства, указываются наименование лекарственного средства, дата заполнения штангласа лекарственным средством, дата окончания срока годности (годен до ____), подпись лица, заполнившего штанглас и подтверждающего, что в штангласе содержится именно указанное лекарственное средство.
- нарушения ведения паспорта письменного контроля.
Пример.
В нарушение п. 120 приказа Минздрава России от 26.10.2015 N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность" в паспорте письменного контроля №2233, заполняемого при изготовлении препарата, отсутствует следующая информация:
- номер рецепта или требования,
- наименования взятых лекарственных средств и их количества, взятых гомеопатических разведений или гомеопатических субстанций. не на латинском языке (на русском).
Указанные нарушения подтверждаются копиями паспорта письменного контроля №2233.
- отсутствует паспорт письменного контроля.
Пример.
В нарушение п. 120 Приказа №751н, паспорт письменного контроля на лекарственный препарат «Антигриппин», анализ №915, серия №336, изготовленный 04.07.2017, по состоянию на 08.08.2017 в аптеке №147 отсутствует.
Согласно объяснительной провизора-аналитика аптеки №147, паспорт письменного контроля был оформлен неправильно, потому было принято решение его переписать, а старый уничтожить.
Паспорт письменного контроля заполняется сразу после изготовления лекарственного препарата, с указанием лекарственных средств на латинском языке, в соответствии с последовательностью технологических операций. Паспорта письменного контроля хранятся в течение двух месяцев со дня изготовления лекарственных препаратов.
- фармацевтические субстанции не включены в государственный реестр.
Пример.
В нарушение требований ч. 2 ст. 56 Федерального закона от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств", п. 3 приказа Минздрава России от 26.10.2015 N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность" аптекой при изготовлении используются субстанции сомнительного качества, так как в представленных документах на фармацевтические субстанции отсутствуют данные о внесение в государственный реестр, паспорта завода изготовителя:
1) «Атропа белла-донна (Беладонна), настойка матричная гомеопатическая, представлен протокол анализа № 673 от 25.09.2014 г.;
2) «Аконит аптечный, настойка матричная гомеопатическая», представлен протоколом анализа № 293 от 09.04.2014 г.
- нарушения по показателю «количественное содержание».
Пример.
В нарушение п. 12 Приказа Минздрава России от 26.10.2015 № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность», фармацевтом К., 04.07.2017 при изготовлении внутриаптечной заготовки «Порошок Антигриппина» (состава: димедрол 0,01; рутин 0,02; аскорбиновая кислота 0,15; кальция глюконат 0,1) в количестве 200 доз, допущено нарушение по показателю «Количественное содержание».
То есть допущена ошибка при смешивании ингредиентов, а именно: в ходе изготовления лекарственной формы, перепутана последовательность добавления и количество лекарственных субстанций: аскорбиновая кислота добавлена в количестве 2,0 г (вместо 30,0 г) и димедрол в количестве 30,0 г (вместо 2,0 г).
В то время как количество димедрола в одной дозе лекарственного препарата «Антигриппин» по прописи 0,01 г, а фактически составляет 0,155 г., т.е. дозировка лекарственного препарата димедрол в лекарственной форме «Антигриппин» завышена в 15,5 раз.
Согласно Государственной Фармакопее X издания - высшая разовая доза димедрола для детей 5 лет составляет 0,02 г. Фактическая доза в изготовленном лекарственном препарате - 0,155 г., что превышает высшую разовую дозу в 7,75 раз.
В соответствии с п. 12. Приказа №751н - измельчение и смешивание порошков осуществляется путем добавления последовательно ингредиентов от меньших количеств к большим количествам в предварительно затертой ступке индифферентным в фармакологическом отношении вспомогательным веществом или лекарственным средством с соблюдением потерь в соответствии с таблицей № 2 приложения № 2 к настоящим Правилам. Остальные ингредиенты при изготовлении порошков добавляются в порядке увеличения их массы при соблюдении соотношения 1:20.
- не проведен качественный и количественный анализ.
Пример.
В нарушение п. 134 Приказа №751н и п.3.7. Инструкции по контролю качества лекарственных средств, изготовляемых в аптечных организациях (аптеках), утвержденной приказом Минздрава РФ от 16.07.1997 №214, внутриаптечная заготовка, лекарственная форма «Антигриппин», на которую имеется методика анализа была изготовлена под наблюдением провизора-аналитика.
Качественный и количественный анализ внутриаптечной заготовки «Антигриппин» провизором-аналитиком аптеки не был проведен.
Кроме того, поскольку имеется методика количественного анализа «Антигриппина», то провизор-аналитик неправомерно сделала запись в Журнале регистрации химического контроля внутриаптечной заготовки за №915 от 04.07.2017, который фактически не проводила, что подтверждается ее объяснительной от 08.08.2017, и записью в журнале регистрации химического контроля внутриаптечной заготовки.
Таким образом, лекарственный препарат «Антигриппин» серия 336, анализ 915, изготовленный 04.07.2017 в количестве 20 упаковок, с нарушением технологии, не прошедший качественный и количественный анализ, поступил в продажу в количестве 20 упаковок и был реализован покупателям согласно выписке «История товара», представленной ГУП УР «АУ» в период с 06.07.2017 по 12.07.2017 в количестве 12 упаковок.
Лекарственная форма «Антигриппин является внутриаптечной заготовкой в силу массовости приобретения.
Согласно пп. «ж» п.134 Приказа №751н, качественному и количественному анализу (полный химический контроль) должны подвергаться в обязательном порядке лекарственные препараты в виде внутриаптечной заготовки каждой серии, кроме гомеопатических лекарственных препаратов.
- фальсификация сроков годности.
Пример.
В ходе проверки выявлено, что аптекой допускается фальсификация сроков годности на изготовленные в аптеке лекарственные препараты.
Так лекарственный препарат, «Антигриппин», анализ №915, серия №336, который согласно записей в Журнале регистрации химического контроля, в Журнале лабораторно-фасовочных работ и объяснительных фармацевта от 18.07.2017 и провизора-аналитика от 08.08.2017 - изготовлен и поступил в продажу 04.07.2017, (срок годности 10 дней, т.е. - до 14.07.2017)
Однако, этот же препарат продан с указанной датой изготовления 11.07.2017 (срок годности 10 дней, до 21.07.2017).
Согласно объяснительной провизора-аналитика, данной при проведении выездной проверки 08.08.2017 «дату (11.07.2017) на Антигриппин поставили утром в день отпуска, чтобы продлить срок годности лекарственной формы в летний период».
Таким образом, своими действиями аптека № 147 вводит в заблуждение потребителя о действительных сроках годности лекарственного препарата.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.).
X. Перевозка
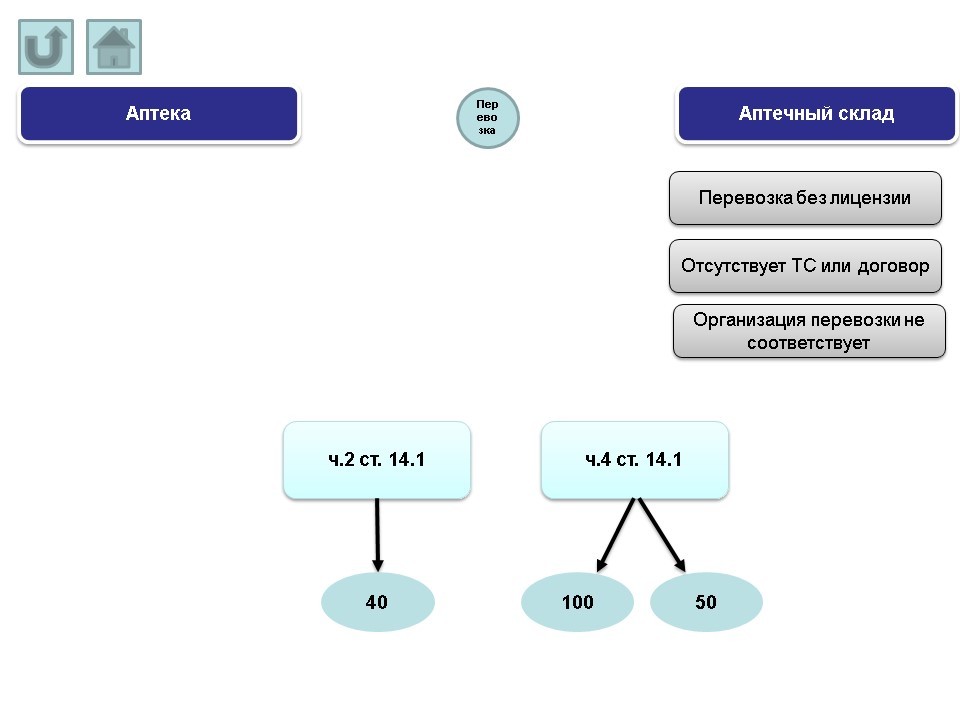
Основные нарушения, допускаемые аптечными складами:
- перевозка без лицензии.
Пример.
В ходе проверки и при анализе представленных документов установлены факты осуществления ЗАО «…» перевозки лекарственных средств для медицинского применения автотранспортом по договору №31 от 10.07.2015 на оказание услуг по транспортировке грузов с ИП … до клиентов на основании договоров поставок лекарственных средств (договор №459 от 02.03.2012 с ИП …; №566 от 12.03.2012 с ООО «…», №612 от 13.07.2012 с ООО «…», №486 от 02.03.2012 с ООО «…») по товарно-транспортным накладным.
Также имеются маршрутные листы (№ 206456-0269 (13.01.2017)), штатным расписанием предусмотрено 12 единиц водителей-экспедиторов и 1 единица аналитика-логиста.
Указанное подтверждает осуществление ЗАО «…» перевозки лекарственных средств для медицинского применения до клиентов без специального разрешения на оказываемый вид работ (услуг) в рамках фармацевтической лицензии и является административным правонарушением (лицензия на фармацевтическую деятельность не предусматривает перевозку лекарственных препаратов).
- отсутствует транспортное средство или договор с организацией, чье транспортное средство осуществляло перевозку лекарственных препаратов.
Пример.
В соответствии с пунктом 62 Правил надлежащей практики хранения и перевозки для перевозки лекарственных препаратов используются транспортные средства и оборудование, обеспечивающие соблюдение их качества, эффективности и безопасности. При перевозке термолабильных лекарственных препаратов используется специализированное оборудование, обеспечивающее поддержание требуемых температурных режимов хранения лекарственных препаратов.
В нарушение указанного пункта на момент проверки у ООО «…» отсутствует автомобиль или договор аутсорсинга для осуществления перевозки лекарственных средств для медицинского применения.
- организация перевозки не соответствует требованиям.
Пример.
Административный орган указывает, что у ООО «…» отсутствуют транспортное средство на праве собственности или ином законном основании, необходимые для перевозки термолабильных ЛП, а также отсутствуют термоконтейнеры, обеспечивающие температурный режим для перевозки, средства измерения, позволяющие подтвердить соблюдение температурного режима в процессе перевозки, отсутствуют документы, подтверждающие обеспечение перевозки лекарственных препаратов в соответствии с требованиями Правил №646н (оборудования, технических средств, персонала, контроль перемещения лекарственных средств, осуществления контроля за соблюдением качества при транспортировке (перемещении) лекарств, подтверждения наличия перевозчиком оборудования, используемого для контроля и поддержания температурного режима в процессе перевозки, порядок подготовки изотермических контейнеров).
Обществом в ходе проведения проверки представлен договор транспортно-экспедиционного обслуживания, заключенного с ООО «…».
Предметом регулирования данного договора является организация перевозки товаров автотранспортом с оплатой согласно тарифам. Из обязанностей исполнителя, правил перевозки груза данного договора не следует, что перевозка , осуществляемая по данному договору охватывает перевозку термолабильных лекарственных препаратов с использованием специализированных транспортных средств. Кроме того, на исполнителя услуг не возложена обязанность осуществления перевозки в соответствии с Правилами №646н, предоставления документов заказчику, позволяющих удостовериться в соблюдении надлежащего температурного режима каждой перевозки с целью обеспечения контроля и гарантии качества лекарственных препаратов.
Документы, представленные в ходе рассмотрения дела (паспорт на регистраторы, свидетельства о поверке регистратора температуры, акты о температурной валидации, во-первых, не позволяют их соотнести с перевозкой, осуществляемой по договору, заключенному с ООО «…», конкретной перевозкой лекарственных средств и транспортным средством, на котором осуществлялась перевозка. Во-вторых, не свидетельствует о наличии постоянного контроля лицензиатом за соблюдением перевозчиком, выбор которого осуществляет по собственному усмотрению АО "…", надлежащих условий перевозки для лекарственных средств (включая термолабильных), а также фиксации информации о перемещении лекарственных средств.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.). Безлицензионная деятельность трактуется по ч.2 ст.14.1 (штраф на юридическое лицо от 40 т.р.).
- перевозка без лицензии.
Пример.
В ходе проверки и при анализе представленных документов установлены факты осуществления ЗАО «…» перевозки лекарственных средств для медицинского применения автотранспортом по договору №31 от 10.07.2015 на оказание услуг по транспортировке грузов с ИП … до клиентов на основании договоров поставок лекарственных средств (договор №459 от 02.03.2012 с ИП …; №566 от 12.03.2012 с ООО «…», №612 от 13.07.2012 с ООО «…», №486 от 02.03.2012 с ООО «…») по товарно-транспортным накладным.
Также имеются маршрутные листы (№ 206456-0269 (13.01.2017)), штатным расписанием предусмотрено 12 единиц водителей-экспедиторов и 1 единица аналитика-логиста.
Указанное подтверждает осуществление ЗАО «…» перевозки лекарственных средств для медицинского применения до клиентов без специального разрешения на оказываемый вид работ (услуг) в рамках фармацевтической лицензии и является административным правонарушением (лицензия на фармацевтическую деятельность не предусматривает перевозку лекарственных препаратов).
- отсутствует транспортное средство или договор с организацией, чье транспортное средство осуществляло перевозку лекарственных препаратов.
Пример.
В соответствии с пунктом 62 Правил надлежащей практики хранения и перевозки для перевозки лекарственных препаратов используются транспортные средства и оборудование, обеспечивающие соблюдение их качества, эффективности и безопасности. При перевозке термолабильных лекарственных препаратов используется специализированное оборудование, обеспечивающее поддержание требуемых температурных режимов хранения лекарственных препаратов.
В нарушение указанного пункта на момент проверки у ООО «…» отсутствует автомобиль или договор аутсорсинга для осуществления перевозки лекарственных средств для медицинского применения.
- организация перевозки не соответствует требованиям.
Пример.
Административный орган указывает, что у ООО «…» отсутствуют транспортное средство на праве собственности или ином законном основании, необходимые для перевозки термолабильных ЛП, а также отсутствуют термоконтейнеры, обеспечивающие температурный режим для перевозки, средства измерения, позволяющие подтвердить соблюдение температурного режима в процессе перевозки, отсутствуют документы, подтверждающие обеспечение перевозки лекарственных препаратов в соответствии с требованиями Правил №646н (оборудования, технических средств, персонала, контроль перемещения лекарственных средств, осуществления контроля за соблюдением качества при транспортировке (перемещении) лекарств, подтверждения наличия перевозчиком оборудования, используемого для контроля и поддержания температурного режима в процессе перевозки, порядок подготовки изотермических контейнеров).
Обществом в ходе проведения проверки представлен договор транспортно-экспедиционного обслуживания, заключенного с ООО «…».
Предметом регулирования данного договора является организация перевозки товаров автотранспортом с оплатой согласно тарифам. Из обязанностей исполнителя, правил перевозки груза данного договора не следует, что перевозка , осуществляемая по данному договору охватывает перевозку термолабильных лекарственных препаратов с использованием специализированных транспортных средств. Кроме того, на исполнителя услуг не возложена обязанность осуществления перевозки в соответствии с Правилами №646н, предоставления документов заказчику, позволяющих удостовериться в соблюдении надлежащего температурного режима каждой перевозки с целью обеспечения контроля и гарантии качества лекарственных препаратов.
Документы, представленные в ходе рассмотрения дела (паспорт на регистраторы, свидетельства о поверке регистратора температуры, акты о температурной валидации, во-первых, не позволяют их соотнести с перевозкой, осуществляемой по договору, заключенному с ООО «…», конкретной перевозкой лекарственных средств и транспортным средством, на котором осуществлялась перевозка. Во-вторых, не свидетельствует о наличии постоянного контроля лицензиатом за соблюдением перевозчиком, выбор которого осуществляет по собственному усмотрению АО "…", надлежащих условий перевозки для лекарственных средств (включая термолабильных), а также фиксации информации о перемещении лекарственных средств.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.). Безлицензионная деятельность трактуется по ч.2 ст.14.1 (штраф на юридическое лицо от 40 т.р.).
XI. ЖНВЛП
Основные нарушения, допускаемые аптеками:
- отсутствует информация в торговом зале.
Пример.
Отсутствие в торговом зале актуализированной информации о максимальных розничных ценах на лекарственные препараты, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, что является нарушением пункта 3 статьи 63 Федерального закона от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств».
- не соответствует протокол согласования.
Протоколы согласования цен поставки лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, не соответствуют форме, установленной Приложением к Правилам установления предельных размеров оптовых и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, в субъектах Российской Федерации. Предпринимателем представлены выписки из протоколов согласования цен, что является нарушением пункта 6 Постановления Правительства РФ от 03.02.2016 №58 «О внесении изменений в постановление Правительства Российской Федерации от 29.10.2010 №865 и признании утратившими силу отдельных положений актов Правительства Российской Федерации».
- оформление протоколов согласования.
Пример.
В протоколах согласования цен поставки лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов графы 14-16 аптекой не заполнены, отсутствует подпись ответственного лица, это является нарушением порядка ценообразования на лекарственные препараты
Основные нарушения, допускаемые аптечными складами:
- несоблюдение температурного режима/влажности.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.) и по ст. 4.1.1 КоАП РФ (предупреждение).
- отсутствует информация в торговом зале.
Пример.
Отсутствие в торговом зале актуализированной информации о максимальных розничных ценах на лекарственные препараты, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, что является нарушением пункта 3 статьи 63 Федерального закона от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств».
- не соответствует протокол согласования.
Протоколы согласования цен поставки лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, не соответствуют форме, установленной Приложением к Правилам установления предельных размеров оптовых и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, в субъектах Российской Федерации. Предпринимателем представлены выписки из протоколов согласования цен, что является нарушением пункта 6 Постановления Правительства РФ от 03.02.2016 №58 «О внесении изменений в постановление Правительства Российской Федерации от 29.10.2010 №865 и признании утратившими силу отдельных положений актов Правительства Российской Федерации».
- оформление протоколов согласования.
Пример.
В протоколах согласования цен поставки лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов графы 14-16 аптекой не заполнены, отсутствует подпись ответственного лица, это является нарушением порядка ценообразования на лекарственные препараты
Основные нарушения, допускаемые аптечными складами:
- несоблюдение температурного режима/влажности.
Протоколы по вышеназванным нарушениям могут быть составлены административным органом по ч.4 ст. 14.1 КоАП РФ (штраф от 100 т.р. на юридическое лицо; в случае решения суда о снижении величины штрафа – 50 т.р.) и по ст. 4.1.1 КоАП РФ (предупреждение).
Ответы на вопросы:
1. Как обеспечить надлежащие условия хранения лекарственных препаратов в регионах с влажным климатом (с повышенной влажностью воздуха)?
- Согласно ГФ XIII, хранение лекарственных средств осуществляется при относительной влажности воздуха 60±5%. Один из вариантов соблюдения данного условия – использование осушителя воздуха.
2. Можно ли использовать стол в материальной комнате как зону приемки товара?
- Если стол в материальной комнате обособлен отдельно (в зоне основного хранения лекарственных средств) и идентифицирован как зона приемки товара, то в данном случае контролирующий орган при проведении проверки не будет расценивать это как нарушение.
3. Сколько карантинных зон должно быть в аптечной организации? Нужно ли выделять отдельно карантинную зона для лекарственных средств наружного и внутреннего применения, БАДов?
- Согласно ГФ XIII, комплекс помещений включает в себя зону карантинного хранения лекарственных препаратов; приказы 706н, 646н и 647н требуют наличия карантинной зоны в аптеке, при этом не указывая на ее разделение по группам. Таким образом, ни один из нормативных документов не требует разделять карантинную зону на лекарственные средства для наружного и внутреннего применения и БАДы.
Пример.
В ходе проведения проверки в отношении аптечной организации было выявлено отсутствие карантинной зоны для хранения термолабильных лекарственных препаратов.
Суд, рассмотрев указанное дело и ссылаясь на Приказ 646н, где указано только обязательное наличие карантинной зоны, но ничего не сказано о выделении отдельной карантинной зоны для термолабильных лекарственных препаратов, принял решение о том, что отдельная карантинная зона для термолабильных препаратов не требуется (в то время как общая карантинная зона в аптечной организации имеется).
4. Обязательно ли наличие термометра на постах старших медицинских сестер? (с учетом, что медикаменты выдаются им на 2-3 дня).
- Для проведения внутреннего контроля соблюдения правил хранения препаратов лучше иметь термометр на постах старших медицинских сестер.
5. Можно ли использовать в аптеке гигрометр без регистрационного удостоверения?
- Гигрометр не является медицинским изделием, поэтому наличие у него регистрационного удостоверения не обязательно (использование гигрометра без регистрационного удостоверения не является нарушением).
6. Должен ли быть термометр в фармацевтическом холодильнике на каждой полке?
- Если фармацевтический холодильник, используемый для хранения термолабильных лекарственных препаратов, поверен и проходит соответствующее техническое обслуживание, то показатели, которые он выдает на табло панели управления, соответствуют действительности, и таким образом нет необходимости в наличии термометров на каждой полке холодильника.
Если же холодильник не поверен и не проходит техническое обслуживание, необходимо проверять показатель температуры на каждой полке: если он разный, необходим отдельный термометр на полку; если температура на всех полках одинаковая – достаточно двух термометров: на верхнюю и нижнюю полку (данная особенность появилась при использовании для хранения термолабильных лекарственных препаратов бытовых холодильников, когда вверху холодильника находилась морозильная камера и, соответственно, температура на верхней полке была ниже, чем на нижней).
7. Возможно ли проведение технического обслуживания своими силами?
- Возможно, если у Вас есть сотрудник, осуществляющий техническое обслуживание и имеющий необходимое профессиональное образование и квалификацию.
В противном случае необходимо заключить договор на техническое обслуживание с организацией, имеющей лицензию на данный вид деятельности.
8. Какие осушители воздуха можно использовать и где их хранить?
- В данном случае в действующем законодательстве не прописано, какие именно осушители необходимы и где они должны храниться. Проверяющая организация смотрит соответствие температуры и влажности, а не марку прибора.
9. Как часто необходимо проводить техническое обслуживание оборудования?
- На каждое оборудование есть эксплуатационная документация, в которой указана периодичность поверки. Также в Приказе 647н указано, что ремонт, поверка и техническое обслуживание осуществляется в соответствии с планом-графиком, утвержденным руководителем.
10. Каким образом ежедневно регистрировать температуру в холодильнике при официальном пятидневном графике работы?
- Государственная фармакопея в данном случае предусматривает наличие терморегистраторов в аптечной организации.
11. Возможно ли размещение на витрине лекарственных препаратов с указанием на вторичной упаковке «Хранить в защищенном от света месте»?
- Согласно Приказу 646н, лекарственные препараты, требующие защиты от воздействия солнечного света должны храниться в помещениях или специально оборудованных зонах, обеспечивающих защиту от попадания на указанные препараты прямых солнечных лучей. Но в ГФ XIII и Приказе 706н идет речь также о «ином ярко направленном свете», что является поводом для дискуссий. Поэтому в данном случае не рекомендуется размещать указанные лекарственные препараты на витрине.
12. Можно ли заменить СОПы на приказы?
- СОПы утверждаются приказами. А заменить сами СОПы на приказы нельзя.
13. Разборку товара осуществляет студентка 4 курса фармацевтического ВУЗа. Возможен ли отпуск ею лекарственных препаратов за отдельной кассой под наблюдением фарм.специалиста?
- В соответствии с лицензионными требованиями, отпуск лекарственных препаратов может осуществлять только специалист, имеющий соответствующее образование и действующий сертификат. В данном случае у студентки 4-го курса нет пока ни образования, ни сертификата, поэтому при проверке контролирующий орган может расценить это как нарушение.
14. Закрывающийся лоток с надписью «Карантинная зона» может находиться в холодильнике?
- Может.
15. Нужно ли техническое обслуживание для кондиционера?
- Если проверка проводится в рамках лицензионного контроля, надзорный орган может обратить внимание на вопрос технического обслуживания системы кондиционирования. Если же проверка будет проводиться в рамках федерального государственного надзора, (т.е. по вопросам чек-листа), поскольку данный вопрос в этом списке отсутствует, надзорный орган не будет проверять факт технического обслуживания кондиционера. Ответы на вопросы:
1. Как обеспечить надлежащие условия хранения лекарственных препаратов в регионах с влажным климатом (с повышенной влажностью воздуха)?
- Согласно ГФ XIII, хранение лекарственных средств осуществляется при относительной влажности воздуха 60±5%. Один из вариантов соблюдения данного условия – использование осушителя воздуха.
2. Можно ли использовать стол в материальной комнате как зону приемки товара?
- Если стол в материальной комнате обособлен отдельно (в зоне основного хранения лекарственных средств) и идентифицирован как зона приемки товара, то в данном случае контролирующий орган при проведении проверки не будет расценивать это как нарушение.
3. Сколько карантинных зон должно быть в аптечной организации? Нужно ли выделять отдельно карантинную зона для лекарственных средств наружного и внутреннего применения, БАДов?
- Согласно ГФ XIII, комплекс помещений включает в себя зону карантинного хранения лекарственных препаратов; приказы 706н, 646н и 647н требуют наличия карантинной зоны в аптеке, при этом не указывая на ее разделение по группам. Таким образом, ни один из нормативных документов не требует разделять карантинную зону на лекарственные средства для наружного и внутреннего применения и БАДы.
Пример.
В ходе проведения проверки в отношении аптечной организации было выявлено отсутствие карантинной зоны для хранения термолабильных лекарственных препаратов.
Суд, рассмотрев указанное дело и ссылаясь на Приказ 646н, где указано только обязательное наличие карантинной зоны, но ничего не сказано о выделении отдельной карантинной зоны для термолабильных лекарственных препаратов, принял решение о том, что отдельная карантинная зона для термолабильных препаратов не требуется (в то время как общая карантинная зона в аптечной организации имеется).
4. Обязательно ли наличие термометра на постах старших медицинских сестер? (с учетом, что медикаменты выдаются им на 2-3 дня).
- Для проведения внутреннего контроля соблюдения правил хранения препаратов лучше иметь термометр на постах старших медицинских сестер.
5. Можно ли использовать в аптеке гигрометр без регистрационного удостоверения?
- Гигрометр не является медицинским изделием, поэтому наличие у него регистрационного удостоверения не обязательно (использование гигрометра без регистрационного удостоверения не является нарушением).
6. Должен ли быть термометр в фармацевтическом холодильнике на каждой полке?
- Если фармацевтический холодильник, используемый для хранения термолабильных лекарственных препаратов, поверен и проходит соответствующее техническое обслуживание, то показатели, которые он выдает на табло панели управления, соответствуют действительности, и таким образом нет необходимости в наличии термометров на каждой полке холодильника.
Если же холодильник не поверен и не проходит техническое обслуживание, необходимо проверять показатель температуры на каждой полке: если он разный, необходим отдельный термометр на полку; если температура на всех полках одинаковая – достаточно двух термометров: на верхнюю и нижнюю полку (данная особенность появилась при использовании для хранения термолабильных лекарственных препаратов бытовых холодильников, когда вверху холодильника находилась морозильная камера и, соответственно, температура на верхней полке была ниже, чем на нижней).
7. Возможно ли проведение технического обслуживания своими силами?
- Возможно, если у Вас есть сотрудник, осуществляющий техническое обслуживание и имеющий необходимое профессиональное образование и квалификацию.
В противном случае необходимо заключить договор на техническое обслуживание с организацией, имеющей лицензию на данный вид деятельности.
8. Какие осушители воздуха можно использовать и где их хранить?
- В данном случае в действующем законодательстве не прописано, какие именно осушители необходимы и где они должны храниться. Проверяющая организация смотрит соответствие температуры и влажности, а не марку прибора.
9. Как часто необходимо проводить техническое обслуживание оборудования?
- На каждое оборудование есть эксплуатационная документация, в которой указана периодичность поверки. Также в Приказе 647н указано, что ремонт, поверка и техническое обслуживание осуществляется в соответствии с планом-графиком, утвержденным руководителем.
10. Каким образом ежедневно регистрировать температуру в холодильнике при официальном пятидневном графике работы?
- Государственная фармакопея в данном случае предусматривает наличие терморегистраторов в аптечной организации.
11. Возможно ли размещение на витрине лекарственных препаратов с указанием на вторичной упаковке «Хранить в защищенном от света месте»?
- Согласно Приказу 646н, лекарственные препараты, требующие защиты от воздействия солнечного света должны храниться в помещениях или специально оборудованных зонах, обеспечивающих защиту от попадания на указанные препараты прямых солнечных лучей. Но в ГФ XIII и Приказе 706н идет речь также о «ином ярко направленном свете», что является поводом для дискуссий. Поэтому в данном случае не рекомендуется размещать указанные лекарственные препараты на витрине.
12. Можно ли заменить СОПы на приказы?
- СОПы утверждаются приказами. А заменить сами СОПы на приказы нельзя.
13. Разборку товара осуществляет студентка 4 курса фармацевтического ВУЗа. Возможен ли отпуск ею лекарственных препаратов за отдельной кассой под наблюдением фарм.специалиста?
- В соответствии с лицензионными требованиями, отпуск лекарственных препаратов может осуществлять только специалист, имеющий соответствующее образование и действующий сертификат. В данном случае у студентки 4-го курса нет пока ни образования, ни сертификата, поэтому при проверке контролирующий орган может расценить это как нарушение.
14. Закрывающийся лоток с надписью «Карантинная зона» может находиться в холодильнике?
- Может.
15. Нужно ли техническое обслуживание для кондиционера?
- Если проверка проводится в рамках лицензионного контроля, надзорный орган может обратить внимание на вопрос технического обслуживания системы кондиционирования. Если же проверка будет проводиться в рамках федерального государственного надзора, (т.е. по вопросам чек-листа), поскольку данный вопрос в этом списке отсутствует, надзорный орган не будет проверять факт технического обслуживания кондиционера.
1. Как обеспечить надлежащие условия хранения лекарственных препаратов в регионах с влажным климатом (с повышенной влажностью воздуха)?
- Согласно ГФ XIII, хранение лекарственных средств осуществляется при относительной влажности воздуха 60±5%. Один из вариантов соблюдения данного условия – использование осушителя воздуха.
2. Можно ли использовать стол в материальной комнате как зону приемки товара?
- Если стол в материальной комнате обособлен отдельно (в зоне основного хранения лекарственных средств) и идентифицирован как зона приемки товара, то в данном случае контролирующий орган при проведении проверки не будет расценивать это как нарушение.
3. Сколько карантинных зон должно быть в аптечной организации? Нужно ли выделять отдельно карантинную зона для лекарственных средств наружного и внутреннего применения, БАДов?
- Согласно ГФ XIII, комплекс помещений включает в себя зону карантинного хранения лекарственных препаратов; приказы 706н, 646н и 647н требуют наличия карантинной зоны в аптеке, при этом не указывая на ее разделение по группам. Таким образом, ни один из нормативных документов не требует разделять карантинную зону на лекарственные средства для наружного и внутреннего применения и БАДы.
Пример.
В ходе проведения проверки в отношении аптечной организации было выявлено отсутствие карантинной зоны для хранения термолабильных лекарственных препаратов.
Суд, рассмотрев указанное дело и ссылаясь на Приказ 646н, где указано только обязательное наличие карантинной зоны, но ничего не сказано о выделении отдельной карантинной зоны для термолабильных лекарственных препаратов, принял решение о том, что отдельная карантинная зона для термолабильных препаратов не требуется (в то время как общая карантинная зона в аптечной организации имеется).
4. Обязательно ли наличие термометра на постах старших медицинских сестер? (с учетом, что медикаменты выдаются им на 2-3 дня).
- Для проведения внутреннего контроля соблюдения правил хранения препаратов лучше иметь термометр на постах старших медицинских сестер.
5. Можно ли использовать в аптеке гигрометр без регистрационного удостоверения?
- Гигрометр не является медицинским изделием, поэтому наличие у него регистрационного удостоверения не обязательно (использование гигрометра без регистрационного удостоверения не является нарушением).
6. Должен ли быть термометр в фармацевтическом холодильнике на каждой полке?
- Если фармацевтический холодильник, используемый для хранения термолабильных лекарственных препаратов, поверен и проходит соответствующее техническое обслуживание, то показатели, которые он выдает на табло панели управления, соответствуют действительности, и таким образом нет необходимости в наличии термометров на каждой полке холодильника.
Если же холодильник не поверен и не проходит техническое обслуживание, необходимо проверять показатель температуры на каждой полке: если он разный, необходим отдельный термометр на полку; если температура на всех полках одинаковая – достаточно двух термометров: на верхнюю и нижнюю полку (данная особенность появилась при использовании для хранения термолабильных лекарственных препаратов бытовых холодильников, когда вверху холодильника находилась морозильная камера и, соответственно, температура на верхней полке была ниже, чем на нижней).
7. Возможно ли проведение технического обслуживания своими силами?
- Возможно, если у Вас есть сотрудник, осуществляющий техническое обслуживание и имеющий необходимое профессиональное образование и квалификацию.
В противном случае необходимо заключить договор на техническое обслуживание с организацией, имеющей лицензию на данный вид деятельности.
8. Какие осушители воздуха можно использовать и где их хранить?
- В данном случае в действующем законодательстве не прописано, какие именно осушители необходимы и где они должны храниться. Проверяющая организация смотрит соответствие температуры и влажности, а не марку прибора.
9. Как часто необходимо проводить техническое обслуживание оборудования?
- На каждое оборудование есть эксплуатационная документация, в которой указана периодичность поверки. Также в Приказе 647н указано, что ремонт, поверка и техническое обслуживание осуществляется в соответствии с планом-графиком, утвержденным руководителем.
10. Каким образом ежедневно регистрировать температуру в холодильнике при официальном пятидневном графике работы?
- Государственная фармакопея в данном случае предусматривает наличие терморегистраторов в аптечной организации.
11. Возможно ли размещение на витрине лекарственных препаратов с указанием на вторичной упаковке «Хранить в защищенном от света месте»?
- Согласно Приказу 646н, лекарственные препараты, требующие защиты от воздействия солнечного света должны храниться в помещениях или специально оборудованных зонах, обеспечивающих защиту от попадания на указанные препараты прямых солнечных лучей. Но в ГФ XIII и Приказе 706н идет речь также о «ином ярко направленном свете», что является поводом для дискуссий. Поэтому в данном случае не рекомендуется размещать указанные лекарственные препараты на витрине.
12. Можно ли заменить СОПы на приказы?
- СОПы утверждаются приказами. А заменить сами СОПы на приказы нельзя.
13. Разборку товара осуществляет студентка 4 курса фармацевтического ВУЗа. Возможен ли отпуск ею лекарственных препаратов за отдельной кассой под наблюдением фарм.специалиста?
- В соответствии с лицензионными требованиями, отпуск лекарственных препаратов может осуществлять только специалист, имеющий соответствующее образование и действующий сертификат. В данном случае у студентки 4-го курса нет пока ни образования, ни сертификата, поэтому при проверке контролирующий орган может расценить это как нарушение.
14. Закрывающийся лоток с надписью «Карантинная зона» может находиться в холодильнике?
- Может.
15. Нужно ли техническое обслуживание для кондиционера?
- Если проверка проводится в рамках лицензионного контроля, надзорный орган может обратить внимание на вопрос технического обслуживания системы кондиционирования. Если же проверка будет проводиться в рамках федерального государственного надзора, (т.е. по вопросам чек-листа), поскольку данный вопрос в этом списке отсутствует, надзорный орган не будет проверять факт технического обслуживания кондиционера. Ответы на вопросы:
1. Как обеспечить надлежащие условия хранения лекарственных препаратов в регионах с влажным климатом (с повышенной влажностью воздуха)?
- Согласно ГФ XIII, хранение лекарственных средств осуществляется при относительной влажности воздуха 60±5%. Один из вариантов соблюдения данного условия – использование осушителя воздуха.
2. Можно ли использовать стол в материальной комнате как зону приемки товара?
- Если стол в материальной комнате обособлен отдельно (в зоне основного хранения лекарственных средств) и идентифицирован как зона приемки товара, то в данном случае контролирующий орган при проведении проверки не будет расценивать это как нарушение.
3. Сколько карантинных зон должно быть в аптечной организации? Нужно ли выделять отдельно карантинную зона для лекарственных средств наружного и внутреннего применения, БАДов?
- Согласно ГФ XIII, комплекс помещений включает в себя зону карантинного хранения лекарственных препаратов; приказы 706н, 646н и 647н требуют наличия карантинной зоны в аптеке, при этом не указывая на ее разделение по группам. Таким образом, ни один из нормативных документов не требует разделять карантинную зону на лекарственные средства для наружного и внутреннего применения и БАДы.
Пример.
В ходе проведения проверки в отношении аптечной организации было выявлено отсутствие карантинной зоны для хранения термолабильных лекарственных препаратов.
Суд, рассмотрев указанное дело и ссылаясь на Приказ 646н, где указано только обязательное наличие карантинной зоны, но ничего не сказано о выделении отдельной карантинной зоны для термолабильных лекарственных препаратов, принял решение о том, что отдельная карантинная зона для термолабильных препаратов не требуется (в то время как общая карантинная зона в аптечной организации имеется).
4. Обязательно ли наличие термометра на постах старших медицинских сестер? (с учетом, что медикаменты выдаются им на 2-3 дня).
- Для проведения внутреннего контроля соблюдения правил хранения препаратов лучше иметь термометр на постах старших медицинских сестер.
5. Можно ли использовать в аптеке гигрометр без регистрационного удостоверения?
- Гигрометр не является медицинским изделием, поэтому наличие у него регистрационного удостоверения не обязательно (использование гигрометра без регистрационного удостоверения не является нарушением).
6. Должен ли быть термометр в фармацевтическом холодильнике на каждой полке?
- Если фармацевтический холодильник, используемый для хранения термолабильных лекарственных препаратов, поверен и проходит соответствующее техническое обслуживание, то показатели, которые он выдает на табло панели управления, соответствуют действительности, и таким образом нет необходимости в наличии термометров на каждой полке холодильника.
Если же холодильник не поверен и не проходит техническое обслуживание, необходимо проверять показатель температуры на каждой полке: если он разный, необходим отдельный термометр на полку; если температура на всех полках одинаковая – достаточно двух термометров: на верхнюю и нижнюю полку (данная особенность появилась при использовании для хранения термолабильных лекарственных препаратов бытовых холодильников, когда вверху холодильника находилась морозильная камера и, соответственно, температура на верхней полке была ниже, чем на нижней).
7. Возможно ли проведение технического обслуживания своими силами?
- Возможно, если у Вас есть сотрудник, осуществляющий техническое обслуживание и имеющий необходимое профессиональное образование и квалификацию.
В противном случае необходимо заключить договор на техническое обслуживание с организацией, имеющей лицензию на данный вид деятельности.
8. Какие осушители воздуха можно использовать и где их хранить?
- В данном случае в действующем законодательстве не прописано, какие именно осушители необходимы и где они должны храниться. Проверяющая организация смотрит соответствие температуры и влажности, а не марку прибора.
9. Как часто необходимо проводить техническое обслуживание оборудования?
- На каждое оборудование есть эксплуатационная документация, в которой указана периодичность поверки. Также в Приказе 647н указано, что ремонт, поверка и техническое обслуживание осуществляется в соответствии с планом-графиком, утвержденным руководителем.
10. Каким образом ежедневно регистрировать температуру в холодильнике при официальном пятидневном графике работы?
- Государственная фармакопея в данном случае предусматривает наличие терморегистраторов в аптечной организации.
11. Возможно ли размещение на витрине лекарственных препаратов с указанием на вторичной упаковке «Хранить в защищенном от света месте»?
- Согласно Приказу 646н, лекарственные препараты, требующие защиты от воздействия солнечного света должны храниться в помещениях или специально оборудованных зонах, обеспечивающих защиту от попадания на указанные препараты прямых солнечных лучей. Но в ГФ XIII и Приказе 706н идет речь также о «ином ярко направленном свете», что является поводом для дискуссий. Поэтому в данном случае не рекомендуется размещать указанные лекарственные препараты на витрине.
12. Можно ли заменить СОПы на приказы?
- СОПы утверждаются приказами. А заменить сами СОПы на приказы нельзя.
13. Разборку товара осуществляет студентка 4 курса фармацевтического ВУЗа. Возможен ли отпуск ею лекарственных препаратов за отдельной кассой под наблюдением фарм.специалиста?
- В соответствии с лицензионными требованиями, отпуск лекарственных препаратов может осуществлять только специалист, имеющий соответствующее образование и действующий сертификат. В данном случае у студентки 4-го курса нет пока ни образования, ни сертификата, поэтому при проверке контролирующий орган может расценить это как нарушение.
14. Закрывающийся лоток с надписью «Карантинная зона» может находиться в холодильнике?
- Может.
15. Нужно ли техническое обслуживание для кондиционера?
- Если проверка проводится в рамках лицензионного контроля, надзорный орган может обратить внимание на вопрос технического обслуживания системы кондиционирования. Если же проверка будет проводиться в рамках федерального государственного надзора, (т.е. по вопросам чек-листа), поскольку данный вопрос в этом списке отсутствует, надзорный орган не будет проверять факт технического обслуживания кондиционера.
Полезная статья? Поделитесь в соцсетях:
Остались вопросы? Задайте их в комментариях, и наши эксперты вам ответят: