Перевозка лекарственных препаратов
В данной статье мы ответим на следующие вопросы:
- кто имеет право осуществлять перевозку лекарственных препаратов;
- какой нормативной документацией регламентирован данный процесс;
- какие существуют основные требования к порядку перевозки лекарственных препаратов.
В соответствии со статьей 4 Федерального закона №61-ФЗ перевозка лекарственных препаратов включена в определение термина «обращение лекарственных средств» (это разработка, доклинические исследования, клинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных средств) и в понятие «фармацевтическая деятельность» (деятельность, включающая в себя оптовую торговлю лекарственными средствами, их хранение, перевозку и (или) розничную торговлю лекарственными препаратами, их отпуск, хранение, перевозку, изготовление лекарственных препаратов).
- кто имеет право осуществлять перевозку лекарственных препаратов;
- какой нормативной документацией регламентирован данный процесс;
- какие существуют основные требования к порядку перевозки лекарственных препаратов.
В соответствии со статьей 4 Федерального закона №61-ФЗ перевозка лекарственных препаратов включена в определение термина «обращение лекарственных средств» (это разработка, доклинические исследования, клинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных средств) и в понятие «фармацевтическая деятельность» (деятельность, включающая в себя оптовую торговлю лекарственными средствами, их хранение, перевозку и (или) розничную торговлю лекарственными препаратами, их отпуск, хранение, перевозку, изготовление лекарственных препаратов).
Обращаем внимание, что в Положение о лицензировании №1081 в перечень выполняемых работ и оказываемых услуг, составляющих фарм. деятельность, также входит перевозка лекарственных средств и лекарственных препаратов.
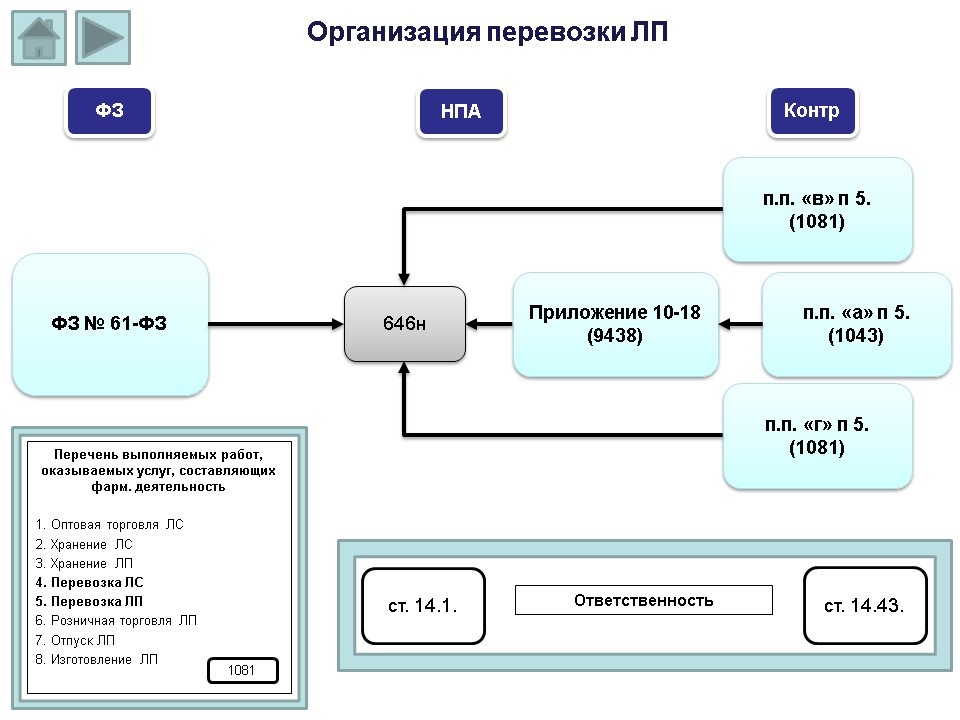
Кроме Федерального закона №61-ФЗ организация перевозки также регламентирована приказом 646н. Следует обратить внимание, что на момент вступления в силу Положения о лицензировании №1081, приказа 646н (с требованиями к перевозке) еще не было, и многие организации, не осуществляющие данный вид деятельности, включали пункт перевозки лекарственных препаратов в свою лицензию.
После вступления в силу 1 марта 2017 года приказа 646н, если в лицензии есть пункт перевозки лекарственных препаратов, организация обязана выполнять установленные к данному виду деятельности требования (даже если на самом деле перевозкой не занимается). Учитывая, что перевозка лекарственных препаратов входит в сферу и лицензионных требований (согласно п.п. «в» п.5 Положения о лицензировании №1081, лицензиат, осуществляющий оптовую торговлю лекарственными средствами, должен соблюдать правила надлежащей практики хранения и перевозки лекарственных препаратов), аптечный склад, имеющий в лицензии право перевозки, в случае проведения проверки в рамках лицензионного контроля, обязательно будет проверен по приказу 646н.
То же самое касается розничной аптечной организации (согласно п.п. «г» п.5 Положения о лицензировании №1081, лицензиат, осуществляющий розничную торговлю лекарственными препаратами, должен соблюдать правила надлежащей практики хранения и перевозки лекарственных препаратов), т.е. аптечная организация, имеющая в лицензии право перевозки, в случае проведения проверки в рамках лицензионного контроля, обязательно будет проверена по приказу 646н.
Что касается проведения проверок в рамках федерального государственного надзора, при наличии в лицензии пункта перевозки лекарственных препаратов, организация также будет проверена по приказу 646н (согласно п.п. «а» п.5 Положения о лицензировании №1081, государственный надзор включает в себя организацию и проведение проверок соблюдения субъектами обращения требований к перевозке).
Напоминаем, что, если речь идет о плановой проверке в рамках федерального государственного надзора, предмет проверки ограничивается перечнем вопросов, включенных в проверочные листы (списки контрольных вопросов), утвержденные приложениями 10-18 приказа Росздравнадзора №9438 (тема проверочных листов (чек-листов) также освещена видеолекцией в нашем сертификационном курсе для провизоров и фармацевтов).
Таким образом, и в рамках федерального государственного надзора и в рамках лицензионного контроля проверка по перевозке осуществляется в части требований приказа 646н.
Что касается административной ответственности за допущенные нарушения, она предусмотрена частью 4 статьи 14.1 КоАП РФ (нарушение п.п. «в» и п.п. «г» п.5 Положения о лицензировании №1081) – штраф от 100 до 200 тыс. рублей; частью 1 статьи 14.43 КоАП РФ (если нет угрозы причинения вреда жизни и здоровью граждан) – штраф от 100 тыс. рублей; и частью 2 статьи 14.43 КоАП РФ (если есть угроза причинения вреда жизни и здоровью граждан) – штраф от 300 тыс. рублей.
Рассмотрим основную документацию, касающуюся перевозки лекарственных препаратов.
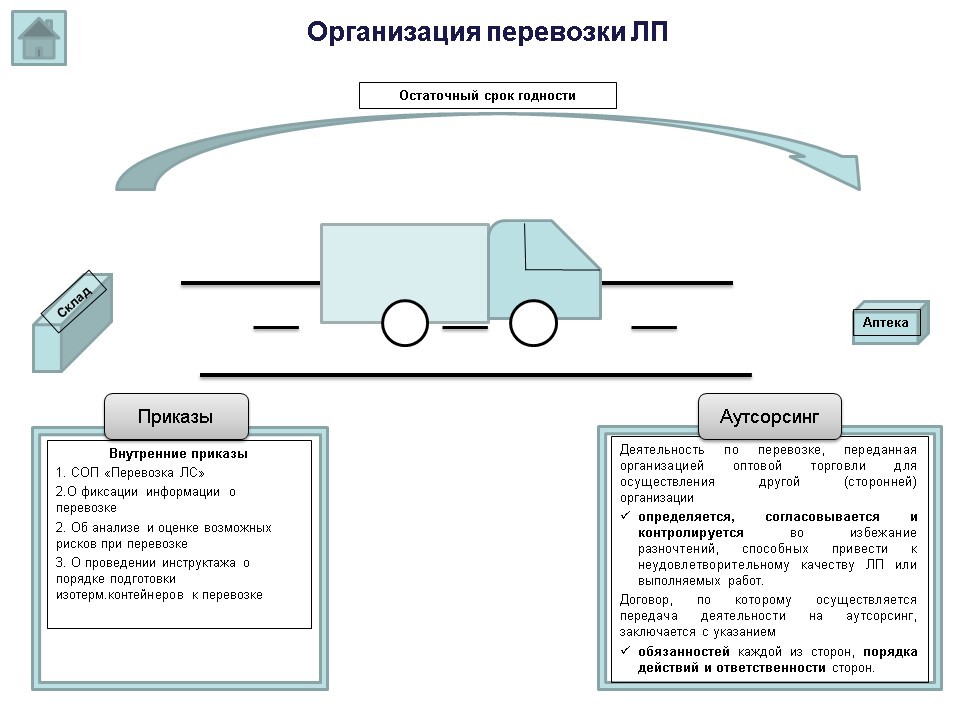
В случае осуществления организацией процедуры перевозки обязательно должен быть в наличии СОП «Перевозка лекарственных средств». В проверочных листах (списках контрольных вопросов) на данный момент присутствует вопрос: фиксируется ли субъектом обращения лекарственных средств информация о их перевозке? Поэтому при проведении проверки, в случае наличия в организации внутреннего приказа о фиксации информации о перевозке, необходимо в качестве подтверждения предоставить данный приказ контролирующему органу.
Согласно п. 60 приказа 646н, планирование перевозки должно осуществляться субъектом обращения лекарственных препаратов на основании проведенного анализа и оценки возможных рисков. Поэтому в случае наличия в аптечной организации внутреннего приказа об анализе и оценке возможных рисков при перевозке (длительные перевозки, транзитные остановки, ремонт оборудования и т.д.), его также необходимо в качестве подтверждения предоставить контролирующему органу.
В соответствии с п. 63 приказа 646н, руководитель субъекта обращения лекарственных препаратов обеспечивает проведение инструктажа о порядке подготовки изотермических контейнеров к перевозке лекарственных препаратов (с учетом сезонных особенностей), а также возможности повторного использования хладоэлементов. Поэтому информация о том, как проводится инструктаж и где это фиксируется, в организации также должна быть.
Субъект обращения лекарственных препаратов при подготовке к перевозке обеспечивает согласование с получателем остаточных сроков годности поставляемых лекарственных препаратов. Проверяющий орган обязательно обратит внимание, происходит ли данное согласование, каким образом и где это указано (в договоре поставки лекарственного препарата либо в других документах).
Деятельность по перевозке, переданная организацией оптовой торговли для осуществления другой (сторонней) организации определяется, согласовывается и контролируется во избежание разночтений, способных привести к неудовлетворительному качеству лекарственных препаратов или выполняемых работ.
Договор, по которому осуществляется передача деятельности на аутсорсинг, заключается с указанием обязанностей каждой из сторон, порядка действий и ответственности сторон.
Кроме Федерального закона №61-ФЗ организация перевозки также регламентирована приказом 646н. Следует обратить внимание, что на момент вступления в силу Положения о лицензировании №1081, приказа 646н (с требованиями к перевозке) еще не было, и многие организации, не осуществляющие данный вид деятельности, включали пункт перевозки лекарственных препаратов в свою лицензию.
После вступления в силу 1 марта 2017 года приказа 646н, если в лицензии есть пункт перевозки лекарственных препаратов, организация обязана выполнять установленные к данному виду деятельности требования (даже если на самом деле перевозкой не занимается). Учитывая, что перевозка лекарственных препаратов входит в сферу и лицензионных требований (согласно п.п. «в» п.5 Положения о лицензировании №1081, лицензиат, осуществляющий оптовую торговлю лекарственными средствами, должен соблюдать правила надлежащей практики хранения и перевозки лекарственных препаратов), аптечный склад, имеющий в лицензии право перевозки, в случае проведения проверки в рамках лицензионного контроля, обязательно будет проверен по приказу 646н.
То же самое касается розничной аптечной организации (согласно п.п. «г» п.5 Положения о лицензировании №1081, лицензиат, осуществляющий розничную торговлю лекарственными препаратами, должен соблюдать правила надлежащей практики хранения и перевозки лекарственных препаратов), т.е. аптечная организация, имеющая в лицензии право перевозки, в случае проведения проверки в рамках лицензионного контроля, обязательно будет проверена по приказу 646н.
Что касается проведения проверок в рамках федерального государственного надзора, при наличии в лицензии пункта перевозки лекарственных препаратов, организация также будет проверена по приказу 646н (согласно п.п. «а» п.5 Положения о лицензировании №1081, государственный надзор включает в себя организацию и проведение проверок соблюдения субъектами обращения требований к перевозке).
Напоминаем, что, если речь идет о плановой проверке в рамках федерального государственного надзора, предмет проверки ограничивается перечнем вопросов, включенных в проверочные листы (списки контрольных вопросов), утвержденные приложениями 10-18 приказа Росздравнадзора №9438 (тема проверочных листов (чек-листов) также освещена видеолекцией в нашем сертификационном курсе для провизоров и фармацевтов).
Таким образом, и в рамках федерального государственного надзора и в рамках лицензионного контроля проверка по перевозке осуществляется в части требований приказа 646н.
Что касается административной ответственности за допущенные нарушения, она предусмотрена частью 4 статьи 14.1 КоАП РФ (нарушение п.п. «в» и п.п. «г» п.5 Положения о лицензировании №1081) – штраф от 100 до 200 тыс. рублей; частью 1 статьи 14.43 КоАП РФ (если нет угрозы причинения вреда жизни и здоровью граждан) – штраф от 100 тыс. рублей; и частью 2 статьи 14.43 КоАП РФ (если есть угроза причинения вреда жизни и здоровью граждан) – штраф от 300 тыс. рублей.
Рассмотрим основную документацию, касающуюся перевозки лекарственных препаратов.
В случае осуществления организацией процедуры перевозки обязательно должен быть в наличии СОП «Перевозка лекарственных средств». В проверочных листах (списках контрольных вопросов) на данный момент присутствует вопрос: фиксируется ли субъектом обращения лекарственных средств информация о их перевозке? Поэтому при проведении проверки, в случае наличия в организации внутреннего приказа о фиксации информации о перевозке, необходимо в качестве подтверждения предоставить данный приказ контролирующему органу.
Согласно п. 60 приказа 646н, планирование перевозки должно осуществляться субъектом обращения лекарственных препаратов на основании проведенного анализа и оценки возможных рисков. Поэтому в случае наличия в аптечной организации внутреннего приказа об анализе и оценке возможных рисков при перевозке (длительные перевозки, транзитные остановки, ремонт оборудования и т.д.), его также необходимо в качестве подтверждения предоставить контролирующему органу.
В соответствии с п. 63 приказа 646н, руководитель субъекта обращения лекарственных препаратов обеспечивает проведение инструктажа о порядке подготовки изотермических контейнеров к перевозке лекарственных препаратов (с учетом сезонных особенностей), а также возможности повторного использования хладоэлементов. Поэтому информация о том, как проводится инструктаж и где это фиксируется, в организации также должна быть.
Субъект обращения лекарственных препаратов при подготовке к перевозке обеспечивает согласование с получателем остаточных сроков годности поставляемых лекарственных препаратов. Проверяющий орган обязательно обратит внимание, происходит ли данное согласование, каким образом и где это указано (в договоре поставки лекарственного препарата либо в других документах).
Деятельность по перевозке, переданная организацией оптовой торговли для осуществления другой (сторонней) организации определяется, согласовывается и контролируется во избежание разночтений, способных привести к неудовлетворительному качеству лекарственных препаратов или выполняемых работ.
Договор, по которому осуществляется передача деятельности на аутсорсинг, заключается с указанием обязанностей каждой из сторон, порядка действий и ответственности сторон.
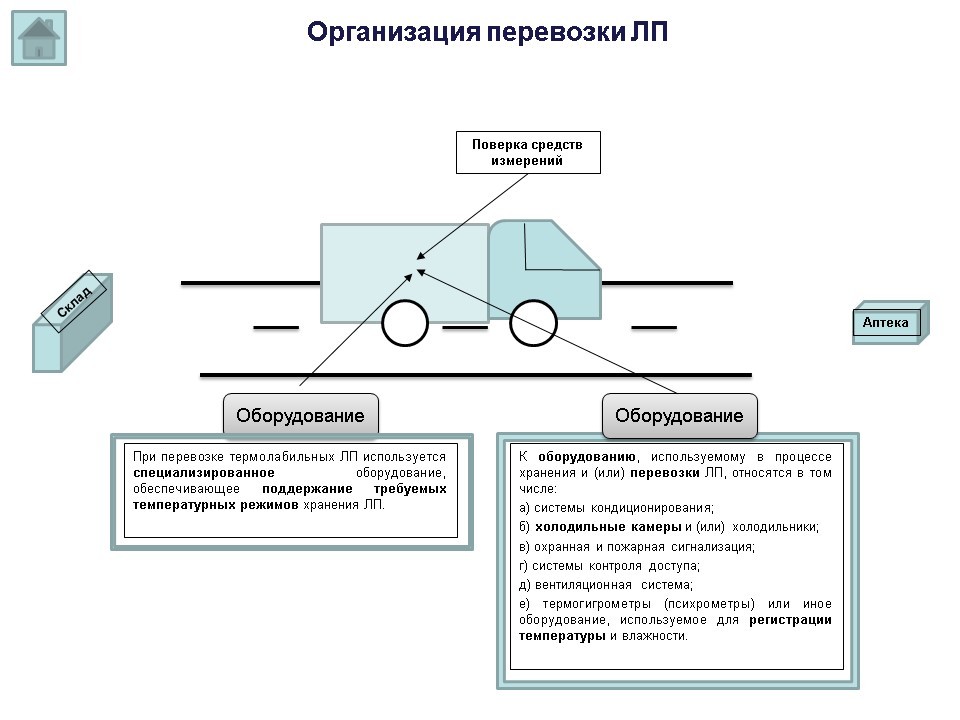
В случае перевозки аптечной организацией лекарственных препаратов самостоятельно, контролирующий орган обратит внимание на наличие транспортного средства, и того факта, на каком основании данное транспортное средство организации принадлежит (аренда и т.д.) и наличие необходимого оборудования, которое должно быть в указанном транспортном средстве, чтобы обеспечить качество перевозимых лекарственных препаратов (при перевозке термолабильных лекарственных препаратов используется специализированное оборудование, обеспечивающее поддержание требуемых температурных режимов).
Согласно п. 37 приказа 646н, к оборудованию, используемому в процессе хранения и (или) перевозки лекарственных препаратов, относятся в том числе:
а) системы кондиционирования;
б) холодильные камеры и (или) холодильники;
в) охранная и пожарная сигнализация;
г) системы контроля доступа;
д) вентиляционная система;
е) термогигрометры (психрометры) или иное оборудование, используемое для регистрации температуры и влажности.
В соответствии с п. 64 приказа 646н, оборудование, установленное внутри транспортного средства или в контейнере, используемое для контроля и поддержания температурного режима в процессе перевозки, относящееся к средствам измерений, подлежит в процессе эксплуатации периодической поверке.
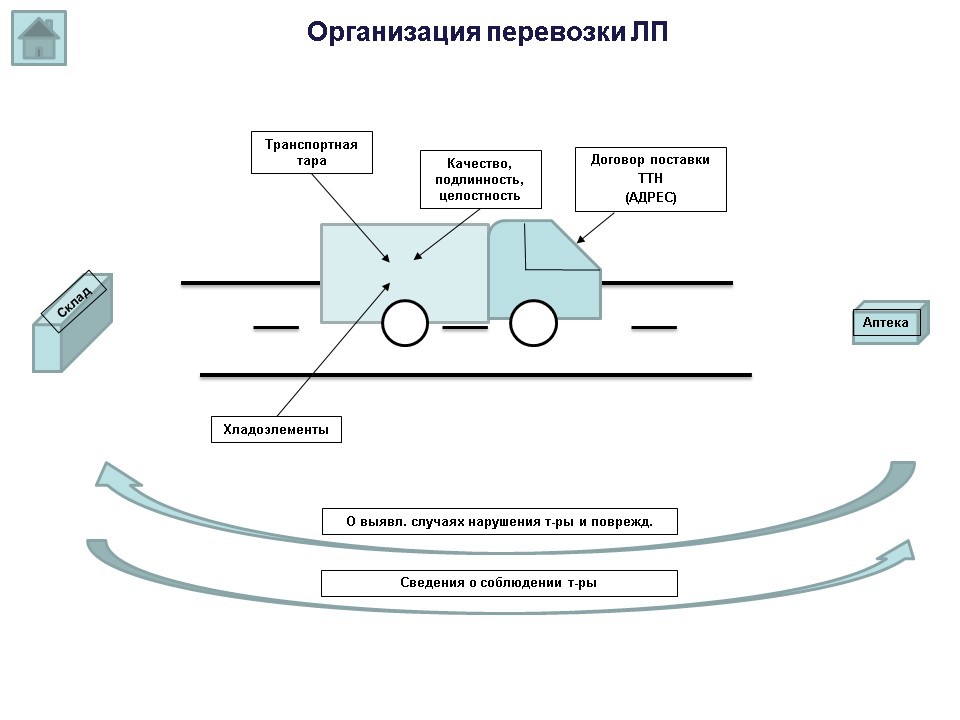
Согласно п.57 приказа 646н, перевозка сопровождается документами в соответствии с требованиями законодательства Российской Федерации (речь идет о договоре поставки и товарно-транспортной накладной, декларации соответствия и т.д.), и в соответствии с п. 65, лекарственные препараты доставляются по адресу, указанному в товарно-сопроводительных документах.
В процессе перевозки, независимо от ее способа, субъектом обращения лекарственных препаратов должна обеспечиваться возможность подтверждения качества, подлинности и целостности лекарственных препаратов.
Вернемся к вопросу изотермических контейнеров и хладоэлементов. В проверочных листах есть вопрос: отсутствует ли прямой контакт хладоэлементов с лекарственными препаратами в процессе перевозки?
Согласно п. 63 приказа 646н, хладоэлементы в изотермических контейнерах должны размещаться таким образом, чтобы отсутствовал прямой контакт с лекарственными препаратами. Стоит также обратить внимание, что повторное использование недостаточно охлажденных и (или) поврежденных хладоэлементов не допускается.
Кроме того, в списках контрольных вопросов есть вопрос, касающийся транспортной тары: каким образом транспортная тара влияет/не оказывает влияния на качество и безопасность лекарственных препаратов? Обеспечивает ли она надежную защиту от воздействия факторов внешней среды? Какая информация должна наноситься на транспортную тару? (согласно п. 71.приказа 646н, на транспортную тару, которая не предназначена для потребителей и в которую помещены лекарственные препараты, должна наноситься информация о наименовании, серии лекарственных препаратов, дате выпуска, количестве вторичных (потребительских) упаковок лекарственных препаратов, производителе лекарственных препаратов с указанием наименований и местонахождения (адрес) производителя лекарственных препаратов, а также о сроке годности лекарственных препаратов и об условиях их хранения и перевозки, необходимые предупредительные надписи и манипуляторные знаки).
Субъект обращения лекарственных препаратов перед осуществлением перевозки самостоятельно выбирает транспортную тару в рамках требований к перевозимым лекарственным препаратам, а также в зависимости от объема, необходимого для размещения лекарственных препаратов, условий окружающей среды и длительности перевозки, включая возможное промежуточное хранение.
Информация о выявленных субъектом обращения лекарственных препаратов в процессе перевозки лекарственного препарата случаях нарушения температурного режима хранения и (или) повреждения упаковки доводится субъектом обращения лекарственных препаратов до отправителя и (или) получателя лекарственных препаратов.
По запросу получателя лекарственных препаратов субъектом обращения лекарственных препаратов должны быть предоставлены сведения о соблюдении температурного режима при перевозке лекарственных препаратов.
В процессе перевозки, независимо от ее способа, субъектом обращения лекарственных препаратов должна обеспечиваться возможность подтверждения качества, подлинности и целостности лекарственных препаратов.
Вернемся к вопросу изотермических контейнеров и хладоэлементов. В проверочных листах есть вопрос: отсутствует ли прямой контакт хладоэлементов с лекарственными препаратами в процессе перевозки?
Согласно п. 63 приказа 646н, хладоэлементы в изотермических контейнерах должны размещаться таким образом, чтобы отсутствовал прямой контакт с лекарственными препаратами. Стоит также обратить внимание, что повторное использование недостаточно охлажденных и (или) поврежденных хладоэлементов не допускается.
Кроме того, в списках контрольных вопросов есть вопрос, касающийся транспортной тары: каким образом транспортная тара влияет/не оказывает влияния на качество и безопасность лекарственных препаратов? Обеспечивает ли она надежную защиту от воздействия факторов внешней среды? Какая информация должна наноситься на транспортную тару? (согласно п. 71.приказа 646н, на транспортную тару, которая не предназначена для потребителей и в которую помещены лекарственные препараты, должна наноситься информация о наименовании, серии лекарственных препаратов, дате выпуска, количестве вторичных (потребительских) упаковок лекарственных препаратов, производителе лекарственных препаратов с указанием наименований и местонахождения (адрес) производителя лекарственных препаратов, а также о сроке годности лекарственных препаратов и об условиях их хранения и перевозки, необходимые предупредительные надписи и манипуляторные знаки).
Субъект обращения лекарственных препаратов перед осуществлением перевозки самостоятельно выбирает транспортную тару в рамках требований к перевозимым лекарственным препаратам, а также в зависимости от объема, необходимого для размещения лекарственных препаратов, условий окружающей среды и длительности перевозки, включая возможное промежуточное хранение.
Информация о выявленных субъектом обращения лекарственных препаратов в процессе перевозки лекарственного препарата случаях нарушения температурного режима хранения и (или) повреждения упаковки доводится субъектом обращения лекарственных препаратов до отправителя и (или) получателя лекарственных препаратов.
По запросу получателя лекарственных препаратов субъектом обращения лекарственных препаратов должны быть предоставлены сведения о соблюдении температурного режима при перевозке лекарственных препаратов.
Полезная статья? Поделитесь в соцсетях:
Остались вопросы? Задайте их в комментариях, и наши эксперты вам ответят: