Единый рынок обращения лекарственных средств и медицинских изделий в рамках ЕАЭС
Евразийский экономический союз (цели создания, органы управления, система нормативно-правовых актов); общий рынок обращения лекарственных средств и медицинских изделий
Эта статья в формате видеолекции здесь.
Эта статья в формате видеолекции здесь.
I. ЕАЭС как организация. Органы управления. Система нормативно-правовых актов.
Датой официального основания Евразийского экономического союза (далее – ЕАЭС) является 1 января 2015 года. Договор о создании ЕАЭС был подписан 25 мая 2014 года между Российской Федерацией, Республикой Казахстан и Республикой Беларусь.
Евразийский экономический союз - международная организация региональной экономической интеграции, обладающая международной правосубъектностью и учрежденная Договором о Евразийском экономическом союзе.
В ЕАЭС обеспечивается свобода движения товаров, а также услуг, капитала и рабочей силы, и проведение скоординированной, согласованной или единой политики в отраслях экономики.
Целями создания ЕАЭС являются:
1) создание условий для стабильного развития экономик государств-членов в интересах повышения жизненного уровня их населения;
2) стремление к формированию единого рынка товаров, услуг, капитала и трудовых ресурсов в рамках Союза;
3) всесторонняя модернизация, кооперация и повышение конкурентоспособности национальных экономик в условиях глобальной экономики.
Органами управления ЕАЭС являются Высший Евразийский экономический совет, Евразийский межправительственный совет, Евразийская экономическая комиссия и Суд Евразийского экономического союза.
Высший Евразийский совет (далее - Высший совет) представляет собой высший орган Союза, в его состав входят главы государств стран-участниц ЕАЭС, заседания проходят не реже 1 раза в год под руководством Председателя (выбирается на ротационной основе из глав государств в порядке русского алфавита). К полномочиям данного органа относится рассмотрение принципиальных вопросов деятельности Союза, определение стратегии, направлений и перспектив развития интеграции и принятие решений, направленных на реализацию целей Союза. На уровне Высшего совета подписываются договоры и соглашения, издаются решения, подлежащие исполнению всеми государствами-членами ЕАЭС в порядке, предусмотренном их национальным законодательством.
Высший межправительственный совет (далее - Межправительственный Совет) создается на уровне глав правительств, заседания проводятся не реже 2 раз в год. Межправительственный Совет обеспечивает реализацию и контроль над исполнением Договора о Союзе, международных договоров в рамках Союза и решений Высшего Совета. Межправительственный Совет издает решения и распоряжения.
Постоянно действующим регулирующим органом ЕАЭС является Евразийская экономическая комиссия (далее - ЕЭК, Комиссия). В состав ЕЭК входят Совет, осуществляющий общее регулирование интеграционных процессов в Союзе, и Коллегия – исполнительный орган ЕЭК. Формирование совета происходит из представителей государств-членов ЕАЭС из принципа равного представительства. Комиссия издаёт решения, распоряжения и рекомендации. Нормативно-правовой характер имеют решения.
Также постоянно действующим органом управления ЕАЭС является Суд ЕАЭС (далее Суд Союза), реализующий свои полномочия по обеспечению единообразного применения государствами-членами и органами Союза Договора, международных договоров Союза с третьей стороной и решений органов Союза. Статус, состав, компетенция, порядок функционирования и формирования Суда Союза определяются Статутом Суда Евразийского экономического союза, согласно Приложению № 2 к Договору о ЕАЭС. В его состав входят по 2 судьи от каждого государства-члена Союза, избираемые сроком на 9 лет. Возглавляет Суд Союза Председатель Суда. Дела рассматриваются по заявлению государства-члена или по заявлению хозяйствующего субъекта.
Систему нормативно-правовых актов (далее – НПА) ЕАЭС можно разделить на три уровня.
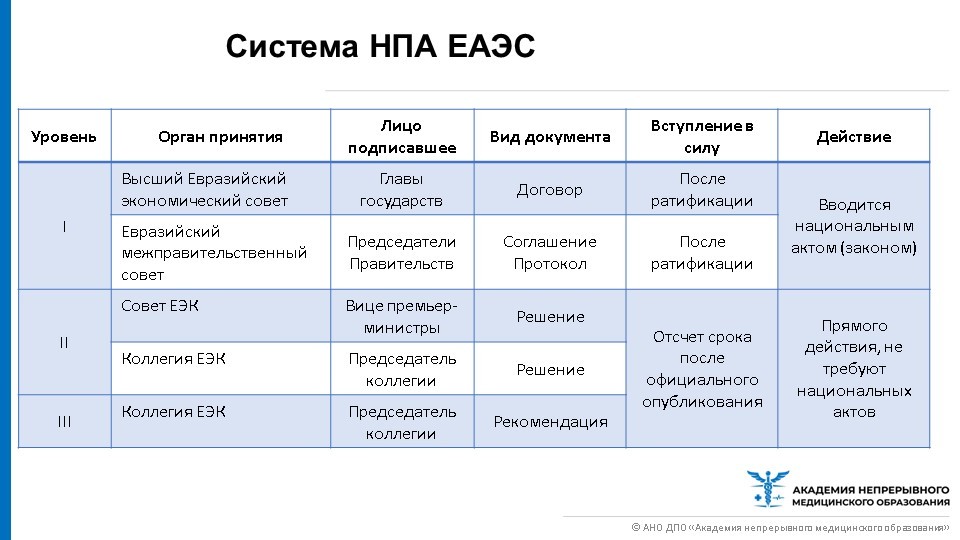
Первый, высший уровень составляют договора, соглашения и протоколы, принимающиеся главами государств или председателями правительств. Вступают в силу после ратификации, вводятся национальным актом (Законом). Второй и третий уровни издаются на уровне Совета или Коллегии ЕЭК – решения, рекомендации. Они уже являются документами прямого действия, не требующие введения национальным актом, вступают в силу после определенного срока с момента их опубликования.
Информацию о всех НПА, принимаемых в рамках Союза, можно найти на его официальном сайте в разделе «Ресурсы», «Правовой портал».
Информацию о всех НПА, принимаемых в рамках Союза, можно найти на его официальном сайте в разделе «Ресурсы», «Правовой портал».
II. Единый (общий) рынок обращения лекарственных средств.
Основу нормативно-правовой базы, регулирующей обращение лекарственных средств в рамках ЕАЭС, составляют Договор о ЕАЭС (далее – Договор) и Соглашение о единых принципах и правилах обращения ЛС в рамках ЕАЭС от 23.12.2014г. (далее – Соглашение).
Согласно статье 30 Договора о ЕАЭС государства-члены ЕАЭС создают в рамках Союза общий рынок лекарственных средств (далее – ЛС), соответствующий стандартам надлежащих фармацевтических практик, на основании следующих принципов:
1) гармонизация и унификация требований законодательства государств-членов;
2) обеспечение единства обязательных требований к качеству и безопасности ЛС, находящихся в обращении на территории ЕАЭС;
3) принятие единых правил в сфере обращения ЛС;
4) разработка и применение одинаковых и сопоставимых методов исследования и контроля;
5) гармонизация законодательства государств-членов в области контроля (надзора) за обращением ЛС;
6) реализация разрешительных и контрольно-надзорных функций в сфере обращения ЛС уполномоченными органами государств-членов.
Дата официального начала работы единого рынка ЛС ЕАЭС – 01.01.2016г. (статья 100 Договора).
Соглашение также устанавливает единые принципы и правила обращения ЛС в рамках Союза, основные направления формирования общего рынка ЛС в соответствии с требованиями надлежащих фармацевтических практик, определяет взаимодействие уполномоченных органов ЕАЭС в сфере обращения ЛС государств-членов, а также предусматривает переходные периоды, обеспечивающие последовательный переход от национального регулирования к единым национальным требованиям.
Соглашение предполагает разделение нормативно-правового регулирования единого рынка обращения ЛС на наднациональный и национальный уровни. В сферу наднационального нормативно-правового регулирования отнесены вопросы разработки, доклинических и клинических исследований, регистрации, производства, контроля качества, оптовой дистрибьюции и фармаконадзора. Розничная дистрибьюция, выпуск ЛС в гражданский оборот, реклама, ценообразование, установление разрешительных и ограничительных перечней, сфера государственных закупок оставлены национальному нормативно-правовому регулированию.
В настоящее время, кроме Договора и Соглашения, издано 37 НПА, регулирующих вопросы обращения ЛС в рамках единого рынка ЛС, 22 из которых –это решения Совета ЕЭК, 7 решений и 8 рекомендаций Коллегии ЕЭК.
Так, вопросы эффективности и безопасности ЛС регулируются следующими НПА.

Сфера контроля и обеспечения качества ЛС также обеспечивается нормами целого ряда НПА:
1) Правила надлежащей производственной практики (Решение Совета ЕЭК №77 от 03.11.2016г.);
2) Правила надлежащей дистрибьюторской практики (Решение Совета ЕЭК №80 от 03.11.2016г.);
3) Правила надлежащей практики выращивания, сбора, обработки и хранения ЛРС (Решение Совета ЕЭК №15 от 26.01.2018г.);
4) Аттестация и реестр уполномоченных лиц (Решение Совета ЕЭК №73 от 03.11.2016г.; (Решение Совета ЕЭК №74 от 03.11.2016г.);
5) Правила проведения фармацевтических инспекций (Решение Совета ЕЭК №83 от 03.11.2016г.);
6) Реестр фармацевтических инспекторов (Решение Совета ЕЭК №90от 03.11.2016г.)
7) Порядок обеспечения проведения совместных фармацевтических инспекций (Решение Совета ЕЭК №91от 03.11.2016г.);
8) Признание результатов инспектирования производства ЛС (Решение Совета ЕЭК №93от 03.11.2016г.);
9) Взаимодействие по выявлению фальсифицированных, контрафактных и (или) недоброкачественных ЛС (Решение Совета ЕЭК №86 от 03.11.2016г.).
В рамках Союза допускается реализация ЛС при условии, что они прошли регистрацию в соответствии с процедурой, устанавливаемой ЕЭК. ЛС, зарегистрированные должны иметь маркировку, соответствующую единым требованиям к маркировке ЛС, утвержденным ЕЭК, а также к ним должна прилагаться инструкция по применению, соответствующая единым требованиям к инструкции по медицинскому применению ЛС, утверждаемым ЕЭК (статья 8 Соглашения).
Регистрации подлежат лекарственные препараты (далее ЛП), то есть ЛС в виде лекарственной формы, фармацевтические субстанции и ряд иных ЛС регистрации в рамках ЕАЭС не подлежат (п.19 Решения Совета ЕЭК от 03.11.2016г. №78 «О правилах регистрации и экспертизы ЛС для медицинского применения»).
Для целей свободного обращения лекарственных средств на территории ЕАЭС были разработаны и с 6 мая 2017 г. вступили в силу правила регистрации и экспертизы лекарственных средств для медицинского применения (Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78). Единые правила предусматривают 2 процедуры регистрации лекарственных средств:
- процедура взаимного признания;
- децентрализованная процедура.
В рамках процедуры взаимного признания ЛС сначала регистрируется в одном из государств — членов ЕАЭС (так называемом референтном государстве), и в этом государстве получает регистрационное удостоверение. После этого ЛС регистрируется в других государствах — членах ЕАЭС (так называемых государствах признания), но уже по сокращенной процедуре, также с получением регистрационного удостоверения в государстве признания.
Отличие децентрализованной процедуры заключается в том, что регистрационное досье оценивается одновременно в референтном государстве и государстве признания. Это позволяет сократить общий срок регистрации в нескольких государствах. Данная процедура регистрации предполагает взаимодействие государственных органов различных государств — членов ЕАЭС через специальную информационную систему. Создание такой системы планируется завершить в ближайшее время, после чего децентрализованная процедура регистрации начнет действовать в полной мере.
Что же касается процедуры взаимного признания, она в настоящий момент уже реализована. Так, государства — члены ЕАЭС обязались взаимно признавать результаты доклинических, клинических и иных исследований лекарственных средств, результаты инспектирования производства, доклинических, клинических исследований лекарственных средств, систем фармаконадзора на соответствие правилам надлежащих фармацевтических практик, а также требованиям, утверждаемым Евразийской экономической комиссией.
Соглашением предусмотрены также переходные положения в процессе регистрации ЛС. До 31.12.2020г. должна быть закончена регистрация ЛС по национальным правилам. До 31.12.2025 года заканчивается действие регистрационных удостоверений (далее – РУ) и регистрационные досье на ЛП, зарегистрированные по национальным правилам, должны быть приведены в соответствие с требованиями ЕАЭС. При этом, ЛП, зарегистрированные в государствах-членах и не приведенные в соответствие с требованиями ЕАЭС до 31.12.2025г., если они произведены в период действия РУ, реализуются до окончания срока их годности.
Согласно приложению 17 Решения Совета ЕЭК от 03.11.2016г. №78 «О правилах регистрации и экспертизы ЛС для медицинского применения», установлена единая форма РУ (номер РУ будет иметь вид - ЛП-№(ХХХХХХ)-(YY-ZZ). На впервые регистрируемые ЛП и ЛП, зарегистрированный менее чем в 3 странах ЕАЭС и (или) обращающийся на рынке менее 5 лет, РУ выдается на 5 лет (отсчет от даты выдачи РУ референтным государством). При перерегистрации нового ЛП и на ЛП, зарегистрированный в 3 странах ЕАЭС и обращающийся на рынке 5 лет и более, выдается РУ бессрочного действия.
П.1, статьи 8 Соглашения также определяет возможность реализации ЛП только при условии, что они прошли регистрацию в соответствии с процедурой, устанавливаемой Комиссией, и сведения о них внесены в Единый реестр зарегистрированных ЛС. Порядок ведения Реестра зарегистрированных ЛП в рамках ЕАЭС закреплен нормами Решения Совета ЕЭК от 03.11.2016г. №84 «О порядках формирования и ведения единого реестра зарегистрированных лекарственных средств Евразийского экономического союза и информационных баз данных в сфере обращения лекарственных средств».
Правила и порядок нанесения маркировки на ЛС, находящихся в обращении в Союзе, регулируются Решением Совета ЕЭК от 03.11.2016г. №76 «Об утверждении требований к маркировке ЛС для медицинского применения», согласно которому маркировка должна наносится на упаковку на русском языке (и на государственных языках государств-членов ЕАЭС, если это предусмотрено их национальным законодательством). Маркировка не должна противоречить регистрационному досье и носить рекламный характер, она должна быть легкочитаемой, понятной, достоверной и не вводить в заблуждение потребителя. Перечень наносимой на первичную и вторичную упаковки информации по правилам ЕАЭС несколько отличается от отечественного, утвержденного Федеральным законом РФ от 12.04.2010г. №61-ФЗ «Об обращении ЛС».
1) Правила надлежащей производственной практики (Решение Совета ЕЭК №77 от 03.11.2016г.);
2) Правила надлежащей дистрибьюторской практики (Решение Совета ЕЭК №80 от 03.11.2016г.);
3) Правила надлежащей практики выращивания, сбора, обработки и хранения ЛРС (Решение Совета ЕЭК №15 от 26.01.2018г.);
4) Аттестация и реестр уполномоченных лиц (Решение Совета ЕЭК №73 от 03.11.2016г.; (Решение Совета ЕЭК №74 от 03.11.2016г.);
5) Правила проведения фармацевтических инспекций (Решение Совета ЕЭК №83 от 03.11.2016г.);
6) Реестр фармацевтических инспекторов (Решение Совета ЕЭК №90от 03.11.2016г.)
7) Порядок обеспечения проведения совместных фармацевтических инспекций (Решение Совета ЕЭК №91от 03.11.2016г.);
8) Признание результатов инспектирования производства ЛС (Решение Совета ЕЭК №93от 03.11.2016г.);
9) Взаимодействие по выявлению фальсифицированных, контрафактных и (или) недоброкачественных ЛС (Решение Совета ЕЭК №86 от 03.11.2016г.).
В рамках Союза допускается реализация ЛС при условии, что они прошли регистрацию в соответствии с процедурой, устанавливаемой ЕЭК. ЛС, зарегистрированные должны иметь маркировку, соответствующую единым требованиям к маркировке ЛС, утвержденным ЕЭК, а также к ним должна прилагаться инструкция по применению, соответствующая единым требованиям к инструкции по медицинскому применению ЛС, утверждаемым ЕЭК (статья 8 Соглашения).
Регистрации подлежат лекарственные препараты (далее ЛП), то есть ЛС в виде лекарственной формы, фармацевтические субстанции и ряд иных ЛС регистрации в рамках ЕАЭС не подлежат (п.19 Решения Совета ЕЭК от 03.11.2016г. №78 «О правилах регистрации и экспертизы ЛС для медицинского применения»).
Для целей свободного обращения лекарственных средств на территории ЕАЭС были разработаны и с 6 мая 2017 г. вступили в силу правила регистрации и экспертизы лекарственных средств для медицинского применения (Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78). Единые правила предусматривают 2 процедуры регистрации лекарственных средств:
- процедура взаимного признания;
- децентрализованная процедура.
В рамках процедуры взаимного признания ЛС сначала регистрируется в одном из государств — членов ЕАЭС (так называемом референтном государстве), и в этом государстве получает регистрационное удостоверение. После этого ЛС регистрируется в других государствах — членах ЕАЭС (так называемых государствах признания), но уже по сокращенной процедуре, также с получением регистрационного удостоверения в государстве признания.
Отличие децентрализованной процедуры заключается в том, что регистрационное досье оценивается одновременно в референтном государстве и государстве признания. Это позволяет сократить общий срок регистрации в нескольких государствах. Данная процедура регистрации предполагает взаимодействие государственных органов различных государств — членов ЕАЭС через специальную информационную систему. Создание такой системы планируется завершить в ближайшее время, после чего децентрализованная процедура регистрации начнет действовать в полной мере.
Что же касается процедуры взаимного признания, она в настоящий момент уже реализована. Так, государства — члены ЕАЭС обязались взаимно признавать результаты доклинических, клинических и иных исследований лекарственных средств, результаты инспектирования производства, доклинических, клинических исследований лекарственных средств, систем фармаконадзора на соответствие правилам надлежащих фармацевтических практик, а также требованиям, утверждаемым Евразийской экономической комиссией.
Соглашением предусмотрены также переходные положения в процессе регистрации ЛС. До 31.12.2020г. должна быть закончена регистрация ЛС по национальным правилам. До 31.12.2025 года заканчивается действие регистрационных удостоверений (далее – РУ) и регистрационные досье на ЛП, зарегистрированные по национальным правилам, должны быть приведены в соответствие с требованиями ЕАЭС. При этом, ЛП, зарегистрированные в государствах-членах и не приведенные в соответствие с требованиями ЕАЭС до 31.12.2025г., если они произведены в период действия РУ, реализуются до окончания срока их годности.
Согласно приложению 17 Решения Совета ЕЭК от 03.11.2016г. №78 «О правилах регистрации и экспертизы ЛС для медицинского применения», установлена единая форма РУ (номер РУ будет иметь вид - ЛП-№(ХХХХХХ)-(YY-ZZ). На впервые регистрируемые ЛП и ЛП, зарегистрированный менее чем в 3 странах ЕАЭС и (или) обращающийся на рынке менее 5 лет, РУ выдается на 5 лет (отсчет от даты выдачи РУ референтным государством). При перерегистрации нового ЛП и на ЛП, зарегистрированный в 3 странах ЕАЭС и обращающийся на рынке 5 лет и более, выдается РУ бессрочного действия.
П.1, статьи 8 Соглашения также определяет возможность реализации ЛП только при условии, что они прошли регистрацию в соответствии с процедурой, устанавливаемой Комиссией, и сведения о них внесены в Единый реестр зарегистрированных ЛС. Порядок ведения Реестра зарегистрированных ЛП в рамках ЕАЭС закреплен нормами Решения Совета ЕЭК от 03.11.2016г. №84 «О порядках формирования и ведения единого реестра зарегистрированных лекарственных средств Евразийского экономического союза и информационных баз данных в сфере обращения лекарственных средств».
Правила и порядок нанесения маркировки на ЛС, находящихся в обращении в Союзе, регулируются Решением Совета ЕЭК от 03.11.2016г. №76 «Об утверждении требований к маркировке ЛС для медицинского применения», согласно которому маркировка должна наносится на упаковку на русском языке (и на государственных языках государств-членов ЕАЭС, если это предусмотрено их национальным законодательством). Маркировка не должна противоречить регистрационному досье и носить рекламный характер, она должна быть легкочитаемой, понятной, достоверной и не вводить в заблуждение потребителя. Перечень наносимой на первичную и вторичную упаковки информации по правилам ЕАЭС несколько отличается от отечественного, утвержденного Федеральным законом РФ от 12.04.2010г. №61-ФЗ «Об обращении ЛС».

Красным шрифтом выделены пункты, которые взаимно отсутствуют в НПА.

Кроме того, особым образом должна быть оформлена информация о ЛП для пациента и для медицинского (и фармацевтического) специалиста, для чего Решение Совета ЕЭК от 03.11.2016г. №78 предусмотрены «инструкция по медицинскому применению» (или «листок-вкладыш» - документ, утверждаемый уполномоченным органом государства-члена в соответствии с актами органов Союза, содержащий информацию для потребителя и сопровождающий лекарственный препарат в упаковке) и «общая характеристика лекарственного препарата» (далее – ОХЛП) (документ, утверждаемый уполномоченным органом государства-члена, в соответствии с актами органов Союза, содержащий информацию для медицинских работников о безопасном и эффективном применении лекарственного препарата). Решением Совета ЕЭК от 03.11.2016г. №88 утверждены требования к инструкции по медицинскому применению лекарственных препаратов и общей характеристике лекарственных препаратов для медицинского применения.

При регистрации ЛП, при подтверждении регистрации (перерегистрации) и внесении в регистрационное досье ЛП изменений (если такие изменения требуют экспертизы ожидаемой пользы по сравнению с возможным риском) уполномоченные органы должны определить принадлежность лекарственного препарата к одной из следующих категорий отпуска:
а) рецептурные препараты;
б) безрецептурные препараты.
Для определения принадлежности лекарственного препарата к категории рецептурных препаратов применяются требования пункта 9 Решения Коллегии ЕЭК от 29.12.2015г. №178 «О правилах определения категории ЛП, отпускаемых без рецепта и по рецепту». Уполномоченные органы могут установить (выделить) особые подкатегории рецептурных препаратов. При этом следует придерживаться следующей градации:
а) рецептурные препараты с обычным рецептурным отпуском;
б) рецептурные препараты, подлежащие особому рецептурному порядку отпуска;
в) рецептурные препараты, подлежащие ограниченному порядку отпуска по специальному требованию и применяемые в специально оговоренных целях.
- «ЛП, отпускаемые без рецепта" - ЛП, отпуск которых пациенту осуществляется без предъявления работнику аптеки пациентом рецепта;
- «ЛП, отпускаемые по рецепту" - ЛП, отпуск которых пациенту осуществляется только после предъявления работнику аптеки пациентом рецепта, выписанного в соответствии с правилами, установленными законодательством государств-членов;
- "ограниченный порядок отпуска" - отпуск ЛП, осуществляемый по специальным требованиям только в учреждения здравоохранения, без отпуска пациентам через аптеки;
- "особый рецептурный порядок отпуска" - отпуск ЛП пациенту, осуществляемый только после предъявления работнику аптеки пациентом рецепта, выписанного на специальном бланке и оформленного особым образом в соответствии с правилами, установленными законодательством государств-членов.
Основные направления организации дистрибьюторской деятельности в рамках Союза регламентированы Решением Совета ЕЭК от 03.11.2016г. №80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза». Надлежащая дистрибьюторская практика (далее – НДП) – это часть системы обеспечения качества, гарантирующая качество ЛС на протяжении всех этапов цепи поставок, включая хранение и транспортировку, от производителя до субъектов, осуществляющих производство, оптовую реализацию или отпуск населению ЛС, включая организации, осуществляющие медицинскую деятельность. Целью НДП является соблюдение надлежащих условий хранения, транспортировки и распространения, необходимых для обеспечения качества, безопасности и эффективности ЛС по всей цепи поставок, а также предотвращение риска проникновения фальсифицированных ЛС в цепь поставки. Требования НДП применяются в отношении всех лиц, участвующих в дистрибьюции ЛС в соответствии с выполняемыми ими функциями, включая дистрибьюторов и производителей ЛС, независимо от ведомственной принадлежности и формы собственности.
Также, в целях гармонизации государственных фармакопей государств-членов было предусмотрено создание Фармакопейного комитета ЕАЭС (Решение Коллегии ЕЭК от 22.09.2015г. №121 «О Положении о Фармакопейном комитете ЕАЭС).
Фармакопейный комитет Союза осуществляет следующие полномочия:
а) разработка модели гармонизации фармакопей государств-членов, определение типов и механизмов гармонизации требований фармакопейных статей (монографий), а также разработка порядка проведения гармонизации фармакопей государств-членов;
б) определение общих подходов к разработке фармакопейных статей (монографий) на различные виды лекарственных средств (субстанции для фармацевтического применения, лекарственное растительное сырье, лекарственные препараты и др.);
д) определение перечня документов и материалов, прилагаемых к проекту фармакопейной статьи (монографии);
е) принятие решения о разработке фармакопейных статей (монографий), обновлении или внесении изменений в фармакопейные статьи (монографии);
и) проведение экспертной оценки проектов фармакопейных статей (монографий), проектов руководств по качеству лекарственных средств и прилагаемых к ним документов и материалов;
к) рассмотрение проектов фармакопейных статей (монографий), проектов руководств по качеству лекарственных средств и прилагаемых к ним документов и материалов и принятие решения об их одобрении или об отказе в одобрении (с указанием причин);
л) подготовка и одобрение проекта Фармакопеи Союза для его внесения на рассмотрение Евразийской экономической комиссией (далее - Комиссия) и др.
а) рецептурные препараты;
б) безрецептурные препараты.
Для определения принадлежности лекарственного препарата к категории рецептурных препаратов применяются требования пункта 9 Решения Коллегии ЕЭК от 29.12.2015г. №178 «О правилах определения категории ЛП, отпускаемых без рецепта и по рецепту». Уполномоченные органы могут установить (выделить) особые подкатегории рецептурных препаратов. При этом следует придерживаться следующей градации:
а) рецептурные препараты с обычным рецептурным отпуском;
б) рецептурные препараты, подлежащие особому рецептурному порядку отпуска;
в) рецептурные препараты, подлежащие ограниченному порядку отпуска по специальному требованию и применяемые в специально оговоренных целях.
- «ЛП, отпускаемые без рецепта" - ЛП, отпуск которых пациенту осуществляется без предъявления работнику аптеки пациентом рецепта;
- «ЛП, отпускаемые по рецепту" - ЛП, отпуск которых пациенту осуществляется только после предъявления работнику аптеки пациентом рецепта, выписанного в соответствии с правилами, установленными законодательством государств-членов;
- "ограниченный порядок отпуска" - отпуск ЛП, осуществляемый по специальным требованиям только в учреждения здравоохранения, без отпуска пациентам через аптеки;
- "особый рецептурный порядок отпуска" - отпуск ЛП пациенту, осуществляемый только после предъявления работнику аптеки пациентом рецепта, выписанного на специальном бланке и оформленного особым образом в соответствии с правилами, установленными законодательством государств-членов.
Основные направления организации дистрибьюторской деятельности в рамках Союза регламентированы Решением Совета ЕЭК от 03.11.2016г. №80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза». Надлежащая дистрибьюторская практика (далее – НДП) – это часть системы обеспечения качества, гарантирующая качество ЛС на протяжении всех этапов цепи поставок, включая хранение и транспортировку, от производителя до субъектов, осуществляющих производство, оптовую реализацию или отпуск населению ЛС, включая организации, осуществляющие медицинскую деятельность. Целью НДП является соблюдение надлежащих условий хранения, транспортировки и распространения, необходимых для обеспечения качества, безопасности и эффективности ЛС по всей цепи поставок, а также предотвращение риска проникновения фальсифицированных ЛС в цепь поставки. Требования НДП применяются в отношении всех лиц, участвующих в дистрибьюции ЛС в соответствии с выполняемыми ими функциями, включая дистрибьюторов и производителей ЛС, независимо от ведомственной принадлежности и формы собственности.
Также, в целях гармонизации государственных фармакопей государств-членов было предусмотрено создание Фармакопейного комитета ЕАЭС (Решение Коллегии ЕЭК от 22.09.2015г. №121 «О Положении о Фармакопейном комитете ЕАЭС).
Фармакопейный комитет Союза осуществляет следующие полномочия:
а) разработка модели гармонизации фармакопей государств-членов, определение типов и механизмов гармонизации требований фармакопейных статей (монографий), а также разработка порядка проведения гармонизации фармакопей государств-членов;
б) определение общих подходов к разработке фармакопейных статей (монографий) на различные виды лекарственных средств (субстанции для фармацевтического применения, лекарственное растительное сырье, лекарственные препараты и др.);
д) определение перечня документов и материалов, прилагаемых к проекту фармакопейной статьи (монографии);
е) принятие решения о разработке фармакопейных статей (монографий), обновлении или внесении изменений в фармакопейные статьи (монографии);
и) проведение экспертной оценки проектов фармакопейных статей (монографий), проектов руководств по качеству лекарственных средств и прилагаемых к ним документов и материалов;
к) рассмотрение проектов фармакопейных статей (монографий), проектов руководств по качеству лекарственных средств и прилагаемых к ним документов и материалов и принятие решения об их одобрении или об отказе в одобрении (с указанием причин);
л) подготовка и одобрение проекта Фармакопеи Союза для его внесения на рассмотрение Евразийской экономической комиссией (далее - Комиссия) и др.
III. Единый (общий) рынок обращения медицинских изделий.
Основу нормативно-правовой базы, регулирующей обращение медицинских изделий (далее – МИ) в рамках ЕАЭС, составляют Договор о ЕАЭС и Соглашение о единых принципах и правилах обращения МИ в рамках ЕАЭС от 23.12.2014г. (далее – Соглашение о МИ).
Статья 31 Договора устанавливает создание общего рынка медицинских изделий Функционирование общего рынка МИ (изделий медицинского назначения и медицинской техники) в рамках Союза осуществляется, начиная с 01.01.2016 г. в соответствии с международным договором в рамках Союза, определяющим единые принципы и правила обращения МИ:
1) гармонизация требований законодательства государств-членов;
2) обеспечение единства обязательных требований к эффективности и безопасности МИ, находящихся в обращении на территории ЕАЭС;
3) принятие единых правил в сфере обращения МИ;
4) определение единых подходов к созданию системы обеспечения качества МИ;
5) гармонизация законодательства государств-членов в области контроля (надзора) в сфере обращения МИ.
Соглашение о единых принципах и правилах обращения МИ в рамках ЕАЭС (от 23.12.2014г., вступ. в силу 01.01.2015г.) устанавливает полномочия ЕЭК по утверждению единых требований и правил в сфере обращения МИ, предусматривает создание информационной системы ЕАЭС в сфере обращения МИ, вводит переходный период до 31.12.2021г., предусматривает наличие единой формы РУ, действующего в рамках ЕАЭС, а также вводит обязательность маркировки МИ специальным знаком обращения на рынке ЕАЭС.
В настоящее время, кроме Договора и Соглашения о МИ, издано 23 НПА, регулирующих вопросы обращения МИ в рамках единого рынка ЛС, 10 из которых –это решения Совета ЕЭК, 11 решений и 2 рекомендаций Коллегии ЕЭК. Вот некоторые из них:
1) Правила регистрации и экспертизы безопасности, качества и эффективности МИ (Решение Совета ЕЭК №46 от 12.02.2016г.);
2) О специальном знаке обращения МИ на рынке ЕАЭС (Решение Совета ЕЭК №26 от 12.02.2016г.);
3) Общие требования безопасности и эффективности МИ, требования к их маркировке и эксплуатационной документации на них (Решение Совета ЕЭК №27 от 12.02.2016г.);
4) Порядок формирования и ведения информационной системы в сфере обращения МИ (Решение Совета ЕЭК №73 от 03.11.2016г.; (Решение Совета ЕЭК №30 от 12.02.2016г.);
5) Перечень видов МИ, подлежащих отнесению при их регистрации к средствам измерений (Решение Совета ЕЭК №42 от 12.02.2016г.)
6) Правила ведения номенклатуры МИ (Решение Коллегии ЕЭК №177 от 29.12.2015г.).
Как уже было сказано, Соглашением о МИ предусматривает переходные положения в процессе формирования единого рынка обращения МИ ЕАЭС: до 31.12.2021 года регистрация МИ осуществляется либо в соответствии с Правилами регистрации и экспертизы безопасности, качества и эффективности (Решение Совета ЕЭК №46 от 12.02.2016г.) либо в соответствии с законодательством государства-члена союза. МИ, зарегистрированные в соответствии с законодательством государства-члена Союза, обращаются на территории только этого государства. РУ, выданные уполномоченным органом государства-члена Союза в соответствии с законодательством этого государства, действительны до окончания срока их действия, но не позднее 31.12.2021г.
Согласно Соглашению о МИ ответственным за выпуск медицинского изделия в обращение в рамках Союза является производитель или его уполномоченный представитель. Запрещается выпуск медицинского изделия в обращение в рамках Союза, если:
а) имеется официальное уведомление уполномоченного органа, производителя и (или) его уполномоченного представителя о том, что обращение медицинского изделия приостановлено, либо оно изъято из обращения, либо оно отозвано производителем;
б) истек срок службы (срок годности) медицинского изделия;
в) медицинское изделие не зарегистрировано в установленном порядке (за исключением медицинских изделий, не подлежащих регистрации в соответствии с пунктом 11 статьи 4 настоящего Соглашения о МИ).
Не подлежат регистрации МИ:
1) ввезенные физическими лицами на таможенную территорию Союза и предназначенные для личного пользования;
2) которые изготовлены на территории государства-члена по индивидуальным заказам пациентов исключительно для личного пользования и к которым предъявляются специальные требования в соответствии с назначением, выданным медицинским работником;
3) ввезенные на таможенную территорию Союза для использования работниками дипломатических представительств и консульских учреждений;
4) ввезенные на таможенную территорию Союза для оказания медицинской помощи пассажирам и членам экипажей транспортных средств, поездных бригад и водителям транспортных средств, прибывших на территорию Союза;
5) ввезенные на таможенную территорию Союза для оказания медицинской помощи участникам международных культурных, спортивных мероприятий и участникам международных экспедиций, а также для проведения выставок;
6) ввезенные на таможенную территорию Союза для проведения исследований (испытаний), в том числе в научных целях;
7) ввезенные на таможенную территорию Союза в качестве гуманитарной помощи в случаях, определяемых законодательством государств-членов.
Порядок регистрации МИ представляет собой выполнение последовательных действий.
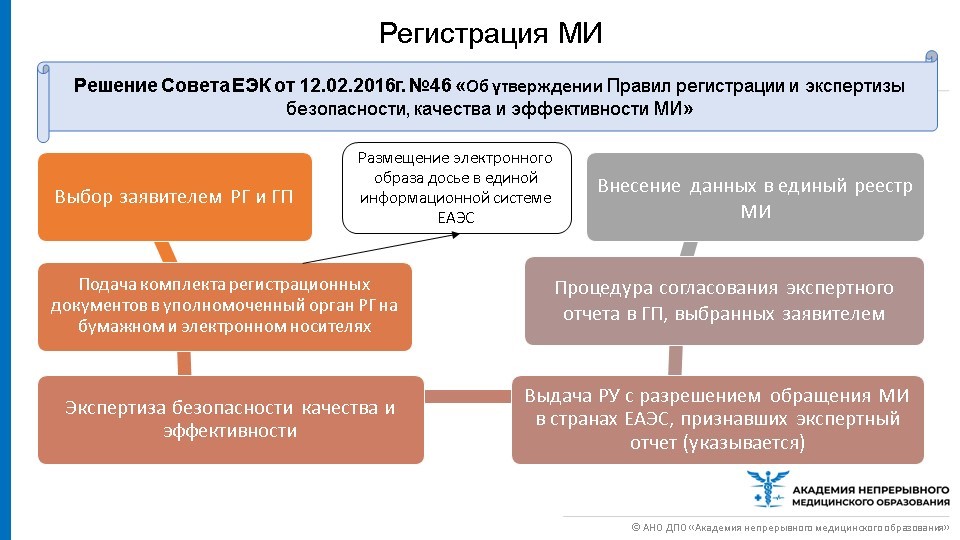
Все зарегистрированные МИ также, как и ЛП, должны быть занесены в Единый реестр. Порядок нанесения маркировки на МИ, обращающихся в рамках Союза регулируется не только НПА ЕАЭС, но и Таможенного союза. Так, согласно Решению Комиссии Таможенного союза от 28.05.2010 №299 «О применении санитарных мер в таможенном союзе» (раздел 18 п.5) маркировка МИ должна быть изложена на русском языке. Допускается дополнительное использование других языков. Информация об изделиях медицинского назначения и медицинской техники должна излагаться изготовителем в маркировке изделий и в документации на него. Маркировка наносится непосредственно на изделие и/или на упаковку. Маркировка должна быть хорошо видна, разборчива, нестираемая, и быть нанесена на самом изделии либо в инструкции по применению.

Решением Совета ЕЭК от 12.02.2016г. №27 также установлены требования к маркировке МИ и эксплуатационной документации на них.

Медицинские изделия, прошедшие установленные в рамках Союза процедуры регистрации и подтверждения соответствия общим требованиям безопасности и эффективности медицинских изделий, требованиям к внедрению и поддержанию системы менеджмента качества медицинских изделий, перед выпуском в обращение в рамках Союза подлежат обязательной маркировке специальным знаком обращения медицинского изделия на рынке Союза (Решение Совета Евразийской экономической комиссии от 12.02.2016 N 26 "О специальном знаке обращения медицинских изделий на рынке Евразийского экономического союза").
Данная тема также рассматривается в наших сертификационных курсах повышения квалификации и переподготовки провизоров и фармацевтов.
Данная тема также рассматривается в наших сертификационных курсах повышения квалификации и переподготовки провизоров и фармацевтов.
Полезная статья? Поделитесь в соцсетях:
Остались вопросы? Задайте их в комментариях, и наши эксперты вам ответят: