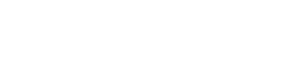Бактериофаги
Механизм действия бактериофагов; применение в медицине.
Лекарственные препараты – бактериофаги; требования при обращении в аптеках.
Косметические средства с бактериофагами; перспективы дальнейшего использования.
Лекарственные препараты – бактериофаги; требования при обращении в аптеках.
Косметические средства с бактериофагами; перспективы дальнейшего использования.
ЧТО ТАКОЕ БАКТЕРИОФАГИ. МЕХАНИЗМ ИХ ДЕЙСТВИЯ
Бактериофаг - ультрамикроскопический, внутриклеточный паразит - вирус, лизирующий бактерии.
Одним из первых, кто наблюдал и детально описал явление лизиса у бактерий, был один из основоположников отечественной медицинской микробиологии — Н. Ф. Гамалея. В 1896 —1898гг. появились его работы, посвященные изучению явления лизиса у сибиреязвенной палочки. Фактор, вызвавший лизис этой бактерии, он назвал бактериолизином.
Позже в 1915 году английский микробиолог Туорт описал явление перевиваемого лизиса у стафилококков и высказал предположение о вирусной природе этого явления.
Для развития исследований в области бактериофагии особое значение имели работы французского ученого Д'Эрелля. В 1917 г. он сообщил, что из фекальных масс больных дизентерией ему удалось выделить особый литический фактор (вирус), способный проходить через бактериальные фильтры, размножаться на дизентерийных бактериях и вызывать при этом их лизис. Для обозначения этого вируса Д'Эрелль впервые предложил название бактериофаг – «пожиратель бактерий» (в переводе с греческого). Бактериофаг обладает всеми основными свойствами, присущими вирусам, а именно:
1) имеет элементарные частицы величиною в пределах от 20 до 200 нм;
2) содержит в своем составе нуклеиновую кислоту и белок;
3) не растет на искусственных питательных средах, размножаясь только внутри клеток микробов;
4) обладает высокой специфичностью в отношении поражаемой клетки;
5) имеет антигенную обособленность от клетки хозяина.
Структура бактериофага (рисунок ниже):
- головка, которая состоит из нуклеиновой кислоты (или ДНК или РНК), окруженной белковой оболочкой;
- может быть отросток – трубчатая белковая структура, через которую нуклеиновая кислота внедряется в клетку, к которой прикрепился бактериофаг;
- могут быть дополнительные структуры – например, базальные пластинки, концевые нити и т.д.
Бактериофаги широко распространены в природе. Почти везде, где условия обитания благоприятны для размножения бактерий, удается обнаружить паразитирующие в их клетках бактериофаги. Их можно выделить из открытых полостей организма человека и животных, различных водоемов, сточных вод, из влажной, унавоженной почвы, из соответствующих культур бактерий и актиномицетов. Много бактериофагов находится в выделениях больных людей и животных, особенно в период выздоровления от инфекционных заболеваний. Большую роль в распространении и сохранении бактериофагов в природе играют так называемые лизогенные бактерии и актиномицеты, постоянно выделяющие бактериофаги во внешнюю среду.
В настоящее время найдены, фаги, лизирующие клетки микроорганизмов, принадлежащих ко всем систематическим группам, как патогенных для человека, животных и растений, так и сапрофитных (непатогенных).
В последние годы найдены фаги, активные против грибов родов пенициллов, аспергиллов и других, а также против некоторых дрожжей. Не выявлены вирусы, активные против простейших, а также спирохет.
Номенклатура бактериофагов основана на видовом наименовании хозяина (стафилококковый, стрептококковый, сальмонеллезный, дизентерийный бактериофаги, коли-бактериофаг и т.п.).
Классификация бактериофагов:
1. По типу нуклеиновой кислоты:
- ДНК-содержащие;
- РНК-содержащие.
2. По характеру взаимодействия с бактериями:
- вирулентные, вызывающие лизис клетки бактерии;
- умеренные (симбиотические), которые не вызывают лизиса бактерий, а остаются в клетке. Микробная клетка становится носителем бактериофага (явление получило название лизогении). Под влиянием фага меняется свойство бактерии (конверсия).
3. По специфичности взаимодействия:
- видовые (моновалентные) – лизируют бактерии одного вида;
- поливалентные – лизируют бактерии разных видов;
- типовые (Т-фаги) – лизируют бактерий разных типов/вариантов (поражают не всех особей данного вида, а только часть из них - делят бактерии в пределах вида на фаговары).
4. По морфологии:
- однонитевые РНК/ДНК-содержащие с аналогом отростка;
- двунитевые ДНК-содержащие;
- в зависимости от наличия и характера основных структурных компонентов – головки и отростка (рисунок ниже): I палочковидные или нитевидные фаги, II фаги, состоящие из одной головки, III фаги, состоящие из головки и короткого отростка, IV фаги, имеющие головку и длинный отросток, чехол которого не может сокращаться, V фаги, имеющие головку и длинный отросток, чехол которого может сокращаться и т.д.
Бактериофаг - ультрамикроскопический, внутриклеточный паразит - вирус, лизирующий бактерии.
Одним из первых, кто наблюдал и детально описал явление лизиса у бактерий, был один из основоположников отечественной медицинской микробиологии — Н. Ф. Гамалея. В 1896 —1898гг. появились его работы, посвященные изучению явления лизиса у сибиреязвенной палочки. Фактор, вызвавший лизис этой бактерии, он назвал бактериолизином.
Позже в 1915 году английский микробиолог Туорт описал явление перевиваемого лизиса у стафилококков и высказал предположение о вирусной природе этого явления.
Для развития исследований в области бактериофагии особое значение имели работы французского ученого Д'Эрелля. В 1917 г. он сообщил, что из фекальных масс больных дизентерией ему удалось выделить особый литический фактор (вирус), способный проходить через бактериальные фильтры, размножаться на дизентерийных бактериях и вызывать при этом их лизис. Для обозначения этого вируса Д'Эрелль впервые предложил название бактериофаг – «пожиратель бактерий» (в переводе с греческого). Бактериофаг обладает всеми основными свойствами, присущими вирусам, а именно:
1) имеет элементарные частицы величиною в пределах от 20 до 200 нм;
2) содержит в своем составе нуклеиновую кислоту и белок;
3) не растет на искусственных питательных средах, размножаясь только внутри клеток микробов;
4) обладает высокой специфичностью в отношении поражаемой клетки;
5) имеет антигенную обособленность от клетки хозяина.
Структура бактериофага (рисунок ниже):
- головка, которая состоит из нуклеиновой кислоты (или ДНК или РНК), окруженной белковой оболочкой;
- может быть отросток – трубчатая белковая структура, через которую нуклеиновая кислота внедряется в клетку, к которой прикрепился бактериофаг;
- могут быть дополнительные структуры – например, базальные пластинки, концевые нити и т.д.
Бактериофаги широко распространены в природе. Почти везде, где условия обитания благоприятны для размножения бактерий, удается обнаружить паразитирующие в их клетках бактериофаги. Их можно выделить из открытых полостей организма человека и животных, различных водоемов, сточных вод, из влажной, унавоженной почвы, из соответствующих культур бактерий и актиномицетов. Много бактериофагов находится в выделениях больных людей и животных, особенно в период выздоровления от инфекционных заболеваний. Большую роль в распространении и сохранении бактериофагов в природе играют так называемые лизогенные бактерии и актиномицеты, постоянно выделяющие бактериофаги во внешнюю среду.
В настоящее время найдены, фаги, лизирующие клетки микроорганизмов, принадлежащих ко всем систематическим группам, как патогенных для человека, животных и растений, так и сапрофитных (непатогенных).
В последние годы найдены фаги, активные против грибов родов пенициллов, аспергиллов и других, а также против некоторых дрожжей. Не выявлены вирусы, активные против простейших, а также спирохет.
Номенклатура бактериофагов основана на видовом наименовании хозяина (стафилококковый, стрептококковый, сальмонеллезный, дизентерийный бактериофаги, коли-бактериофаг и т.п.).
Классификация бактериофагов:
1. По типу нуклеиновой кислоты:
- ДНК-содержащие;
- РНК-содержащие.
2. По характеру взаимодействия с бактериями:
- вирулентные, вызывающие лизис клетки бактерии;
- умеренные (симбиотические), которые не вызывают лизиса бактерий, а остаются в клетке. Микробная клетка становится носителем бактериофага (явление получило название лизогении). Под влиянием фага меняется свойство бактерии (конверсия).
3. По специфичности взаимодействия:
- видовые (моновалентные) – лизируют бактерии одного вида;
- поливалентные – лизируют бактерии разных видов;
- типовые (Т-фаги) – лизируют бактерий разных типов/вариантов (поражают не всех особей данного вида, а только часть из них - делят бактерии в пределах вида на фаговары).
4. По морфологии:
- однонитевые РНК/ДНК-содержащие с аналогом отростка;
- двунитевые ДНК-содержащие;
- в зависимости от наличия и характера основных структурных компонентов – головки и отростка (рисунок ниже): I палочковидные или нитевидные фаги, II фаги, состоящие из одной головки, III фаги, состоящие из головки и короткого отростка, IV фаги, имеющие головку и длинный отросток, чехол которого не может сокращаться, V фаги, имеющие головку и длинный отросток, чехол которого может сокращаться и т.д.
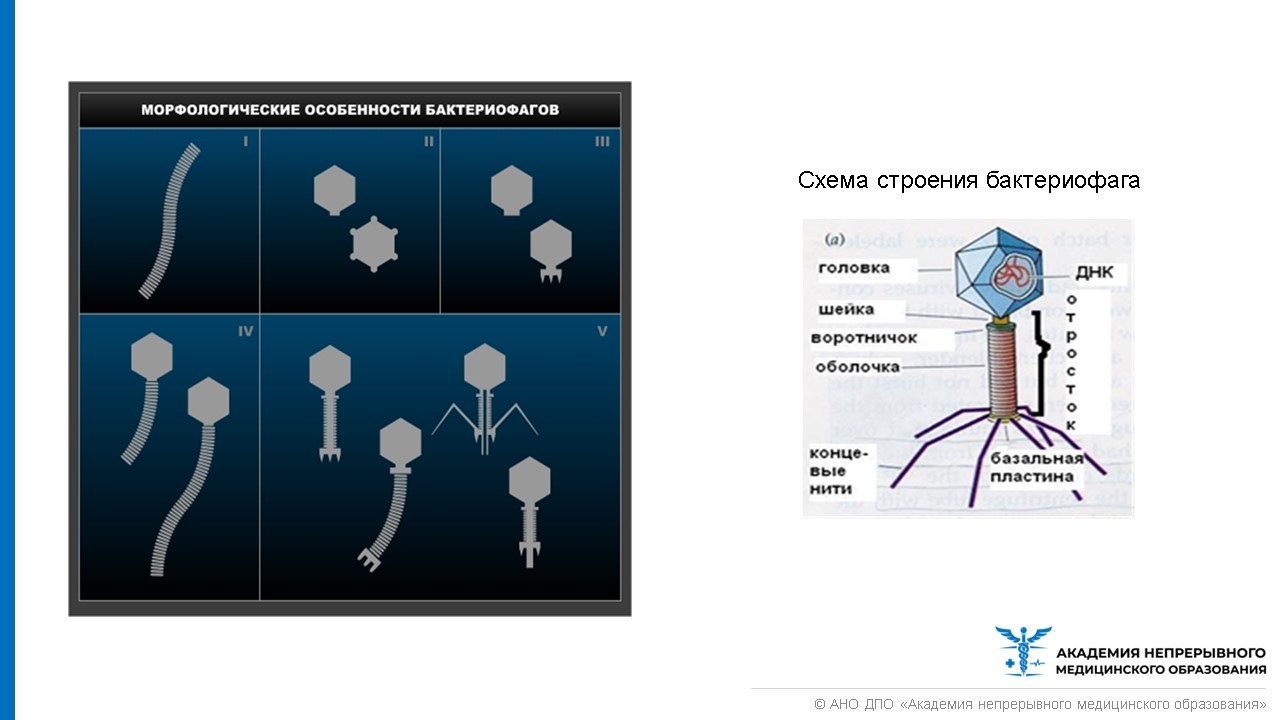
Взаимодействие бактериофага с оболочкой бактерии, а также этапы и исход взаимодействия фагов с бактериальной клеткой представлены на рисунке ниже.
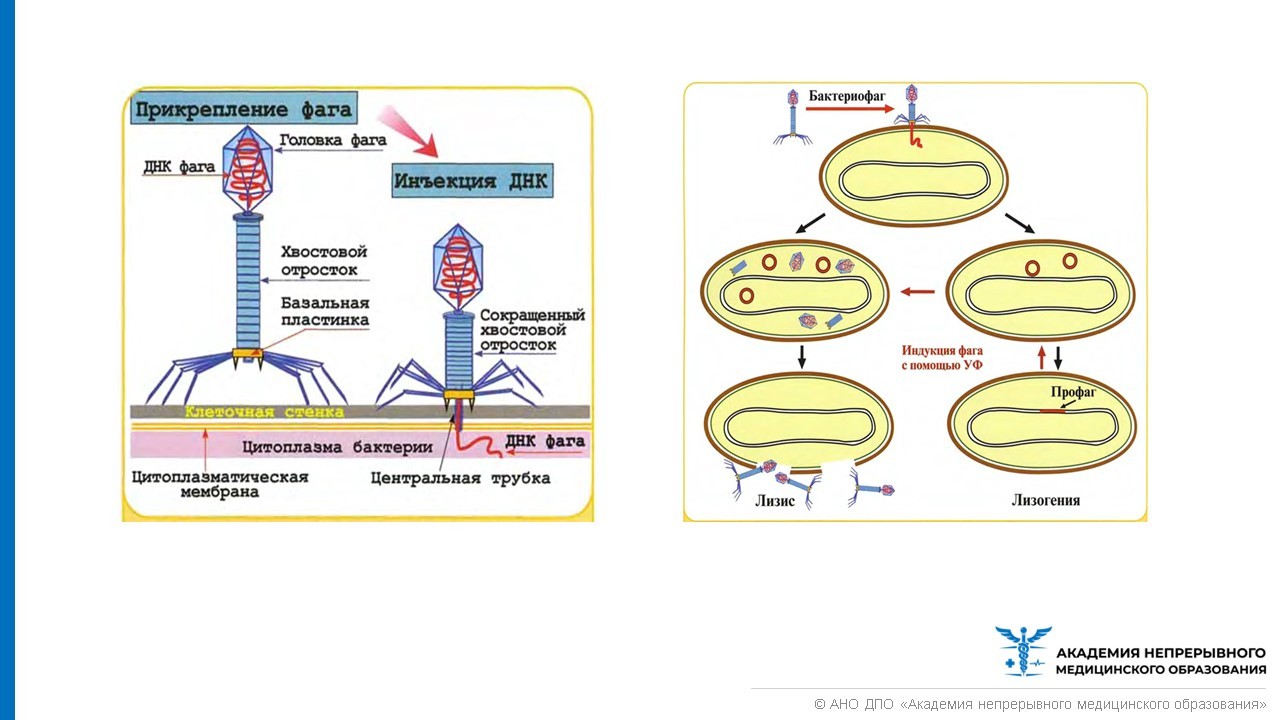
Если имеется крупная колония бактерий, где своих жертв найдут и следующие поколения фагов, то уничтожение бактерий литическими (убивающими, дословно — растворяющими) фагами идет быстро и непрерывно. Если потенциальных жертв мало или внешние условия не слишком подходят для эффективного размножения фагов, то преимущество получают фаги с лизогенным циклом развития. В этом случае после внедрения внутрь бактерии ДНК фага не сразу запускает механизм инфекции, а до поры до времени существует внутри клетки в пассивном состоянии, часто внедряясь в бактериальный геном. В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой бактерии циклы деления клетки. И лишь, когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции. При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг. Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами — организмами без клеточных ядер.
ПРИМЕНЕНИЕ БАКТЕРИОФАГОВ В МЕДИЦИНЕ
Исторически сложилось, что СССР занимал лидирующие позиции в области производства и применения лечебно-профилактических бактериофагов. Применение бактериофагов при лечении инфекционных заболеваний началось почти сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
Столетняя история фаготерапии бактериальных инфекций такова, что основные клинические испытания были проведены задолго до разработки надежной экспериментальной модели инфекционной патологии на лабораторных животных и внедрения в медицинскую практику для вновь регистрируемых лекарственных средств высоких стандартов двойного слепого плацебо-контролируемого исследование. С появлением антибиотиков интерес к фагам был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и вновь проводить их испытания. Этому способствует и развитие новых представлений в конце ХХ - начале ХХI в. как о молекулярной биологии, так и об экологических взаимоотношениях бактериофагов и их хозяев.
Сейчас бактериофаги в медицинской практике применяется в диагностике, лечении и профилактике инфекционных заболеваний.
Фагодиагностика (фагоиндикация) – выделение бактериофагов из организма больного и объектов внешней среды (что косвенно свидетельствует о наличии в материале соответствующих бактерий). В процессе диагностики важно проводить фагоидентификацию, которая включает в себя:
- фагодифференцировку - установление вида (идентификация) бактерий по их чувствительности к известному фагу;
- фаготипирование – установление типа - внутривидовое типирование бактерий по их чувствительности к типовым бактериофагам (важно для эпидемиологического анализа заболевания – установление источника и путей распространения заболевания).
Фаготерапия – применение бактериофагов с целью лечения инфекционных заболеваний (например, пиобактериофаг, дизентирийный и синегнойный бактериофаги).
Фагопрофилактика – применение бактериофагов с целью предупреждения заболеваний в эпидемическом очаге (например, дизентерийный, сальмонеллезный и стафилококковый бактериофаги). В настоящее время фаги применяются для экстренной профилактики брюшного тифа и дизентерии. Под экстренной профилактикой понимается комплекс мероприятий для предотвращения развития болезни до и/или непосредственно после процесса инфицирования.
Достоинств у бактериофагов как потенциальных лекарств множество, но и недостатков не мало. К несомненным достоинствам относится, во-первых, их большое количество, на фоне этого всегда можно подобрать подходящий бактериофаг. Во‑вторых, бактериофаги строго специфичны, то есть они уничтожают только определенный вид микробов, не угнетая при этом нормальную микрофлору человека. В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться. Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий.
Проблемы применения бактериофагов проистекают из их достоинств. Прежде всего высокая специфичность бактериофагов требует точной диагностики патогенного микроба вплоть до штамма. Например, препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерово, так как болезнь могут вызывать разные штаммы бактерий. Фагодиагностика с использованием быстрых методов типирования внедряется медленно из-за дороговизны аппаратуры. В идеальных условиях терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная отечественная медицина практически не готова.
Другой важный недостаток фагов — их биологическая природа. Кроме того, что бактериофаги для поддержания жизнеспособности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто. Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение — проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, — на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника — то проблем не возникает. Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например, возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
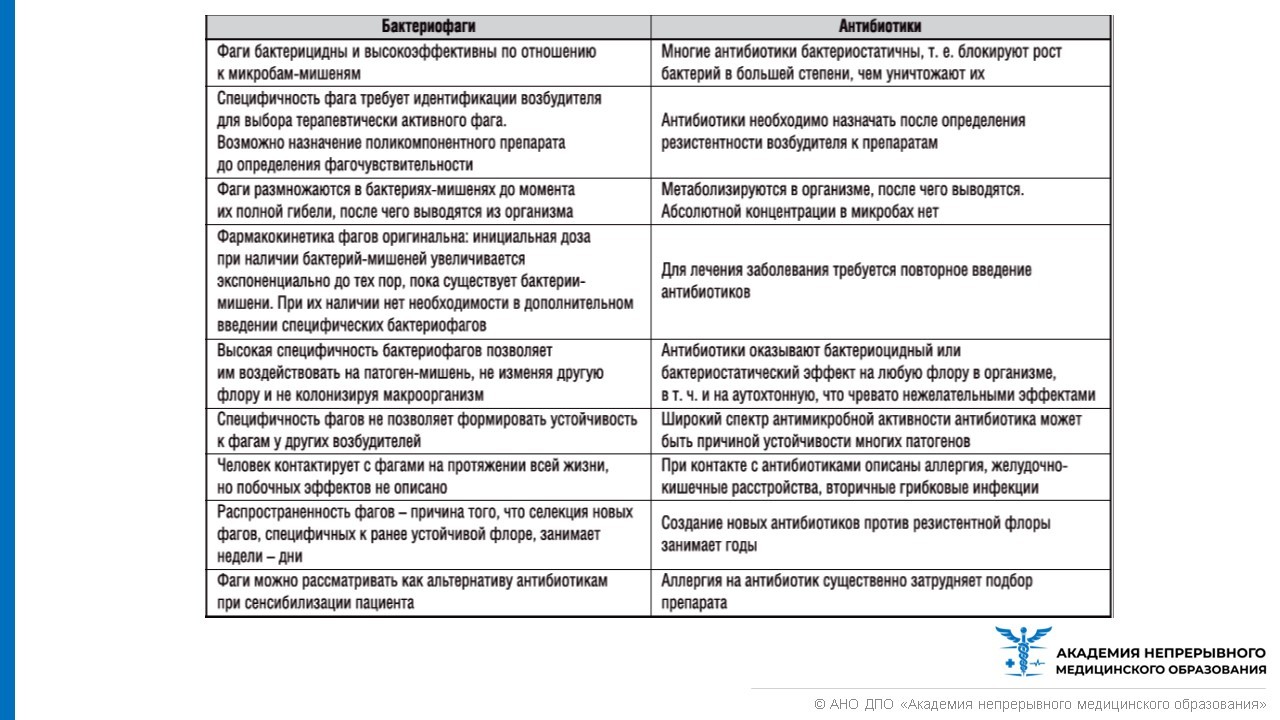
Сравнительные возможности терапии фагами и антибиотиками представлены в таблице ниже.
ПРИМЕНЕНИЕ БАКТЕРИОФАГОВ В МЕДИЦИНЕ
Исторически сложилось, что СССР занимал лидирующие позиции в области производства и применения лечебно-профилактических бактериофагов. Применение бактериофагов при лечении инфекционных заболеваний началось почти сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
Столетняя история фаготерапии бактериальных инфекций такова, что основные клинические испытания были проведены задолго до разработки надежной экспериментальной модели инфекционной патологии на лабораторных животных и внедрения в медицинскую практику для вновь регистрируемых лекарственных средств высоких стандартов двойного слепого плацебо-контролируемого исследование. С появлением антибиотиков интерес к фагам был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и вновь проводить их испытания. Этому способствует и развитие новых представлений в конце ХХ - начале ХХI в. как о молекулярной биологии, так и об экологических взаимоотношениях бактериофагов и их хозяев.
Сейчас бактериофаги в медицинской практике применяется в диагностике, лечении и профилактике инфекционных заболеваний.
Фагодиагностика (фагоиндикация) – выделение бактериофагов из организма больного и объектов внешней среды (что косвенно свидетельствует о наличии в материале соответствующих бактерий). В процессе диагностики важно проводить фагоидентификацию, которая включает в себя:
- фагодифференцировку - установление вида (идентификация) бактерий по их чувствительности к известному фагу;
- фаготипирование – установление типа - внутривидовое типирование бактерий по их чувствительности к типовым бактериофагам (важно для эпидемиологического анализа заболевания – установление источника и путей распространения заболевания).
Фаготерапия – применение бактериофагов с целью лечения инфекционных заболеваний (например, пиобактериофаг, дизентирийный и синегнойный бактериофаги).
Фагопрофилактика – применение бактериофагов с целью предупреждения заболеваний в эпидемическом очаге (например, дизентерийный, сальмонеллезный и стафилококковый бактериофаги). В настоящее время фаги применяются для экстренной профилактики брюшного тифа и дизентерии. Под экстренной профилактикой понимается комплекс мероприятий для предотвращения развития болезни до и/или непосредственно после процесса инфицирования.
Достоинств у бактериофагов как потенциальных лекарств множество, но и недостатков не мало. К несомненным достоинствам относится, во-первых, их большое количество, на фоне этого всегда можно подобрать подходящий бактериофаг. Во‑вторых, бактериофаги строго специфичны, то есть они уничтожают только определенный вид микробов, не угнетая при этом нормальную микрофлору человека. В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться. Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий.
Проблемы применения бактериофагов проистекают из их достоинств. Прежде всего высокая специфичность бактериофагов требует точной диагностики патогенного микроба вплоть до штамма. Например, препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерово, так как болезнь могут вызывать разные штаммы бактерий. Фагодиагностика с использованием быстрых методов типирования внедряется медленно из-за дороговизны аппаратуры. В идеальных условиях терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная отечественная медицина практически не готова.
Другой важный недостаток фагов — их биологическая природа. Кроме того, что бактериофаги для поддержания жизнеспособности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто. Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение — проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, — на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника — то проблем не возникает. Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например, возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Сравнительные возможности терапии фагами и антибиотиками представлены в таблице ниже.
Бактериофаги служат не столько альтернативой, сколько дополнением и усилением в борьбе с инфекциями. Нужно отметить, что противопоставлять применение бактериофагов и антибиотиков в медицинских целях не следует. При совместном их действии наблюдается взаимное усиление противобактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Соответственно, и механизм выработки у бактерий устойчивости к обоим компонентам комбинированного лекарства почти невозможен. Расширение арсенала противомикробных препаратов дает больше степеней свободы в выборе методики лечения. Таким образом, научно обоснованное развитие концепции применения бактериофагов в противомикробной терапии — перспективное направление.
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ - БАКТЕРИОФАГИ
Единственным производителем бактериофагов – лекарственных препаратов в России является АО «НПО «Микроген». Бактериофаги других производителей в России на сегодняшний момент в качестве лекарственных препаратов не зарегистрированы.
Отечественное производство бактериофагов базируется на следующих критериях:
- препараты должны включать только вирулентные бактериофаги;
- фаги, входящие в препарат, должны обладать высокими показателями активности репликации;
- фаги, входящие в препарат, должны сохранять литическую активность при длительном хранении;
- фаги, входящие в препарат, не должны взаимодействовать с представителями облигатной симбиотической микробиоты человека.
АО «НПО «Микроген» производит лекарственные препараты бактериофагов, предназначенные для борьбы с инфекционными заболеваниями, вызванными патогенными и условно-патогенными возбудителями. Эти препараты представляют собой стерильные фильтраты фаголизатов соответствующих видов бактерий, очищенные от эндо- и экзотоксинов, продуктов фаголизиса бактериальных клеток, а также их антигенных комплексов и компонентов питательных сред.
Организация производства лечебно-профилактических бактериофагов осуществляется согласно действующим государственным санитарным правилам с учетом требований системы обеспечения качества надлежащей практики производства. В производственных условиях для изготовления препарата бактериофага применяются только апробированные штаммы бактериофагов (маточные бактериофаги) и культуры соответствующих микробов (производственные штаммы бактерий-продуцентов), обладающих типичными морфологическими, биохимическими и серологическими свойствами.
Бактериофаги проходят контроль на стерильность, безвредность (аномальную токсичность) и литическую активность (вирулентность).
Стерильность бактериофага проверяют обычными способами согласно Государственной фармакопеи. Безвредность препарата проверяют путем его введения белым мышам подкожно. Наблюдение за животными ведется в течение 2 суток; если препарат безвреден, мыши должны оставаться живыми и бодрыми. Литическая активность бактериофага, его вирулентность определяются методом титрования на жидкой и плотной питательной среде. За титр бактериофага при определении методом Аппельмана принимают то наибольшее разведение его, которое вызывает полное растворение соответствующих микробов.
Современные лечебно-профилактические бактериофаги представляют собой комплекс поликлональных бактериальных вирусов, обладающих высокой литической активностью в отношении наиболее эпидемиологически значимых групп возбудителей бактериальных инфекций (бактерий сем. Enterobacteriaceae, родов Staphylococcus, Streptococcus, Pseudomonas и пр.). Бактериофаги выпускают в виде растворов и таблеток. Способы применения – аппликационный, орошение, введение в полости, ректально и перорально.
Парентеральный путь введения сейчас не используется, так как он приводит к развитию иммунного ответа на чужеродный фаговый белок.
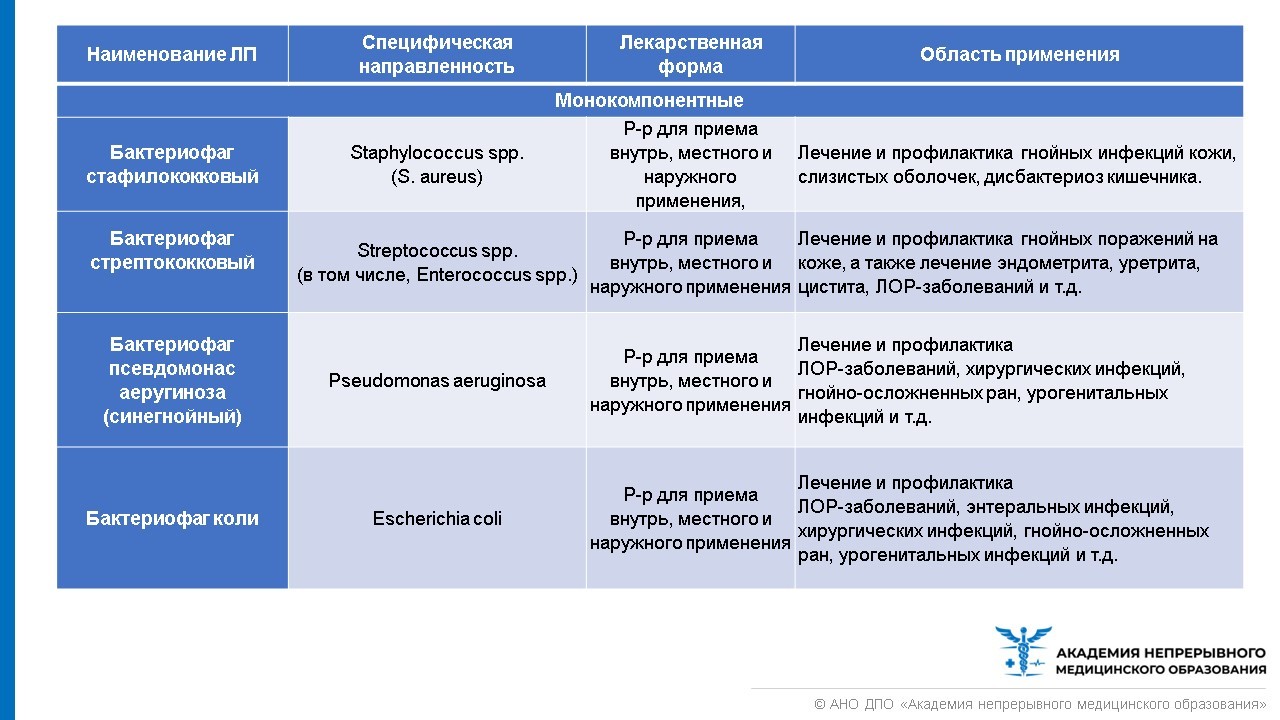
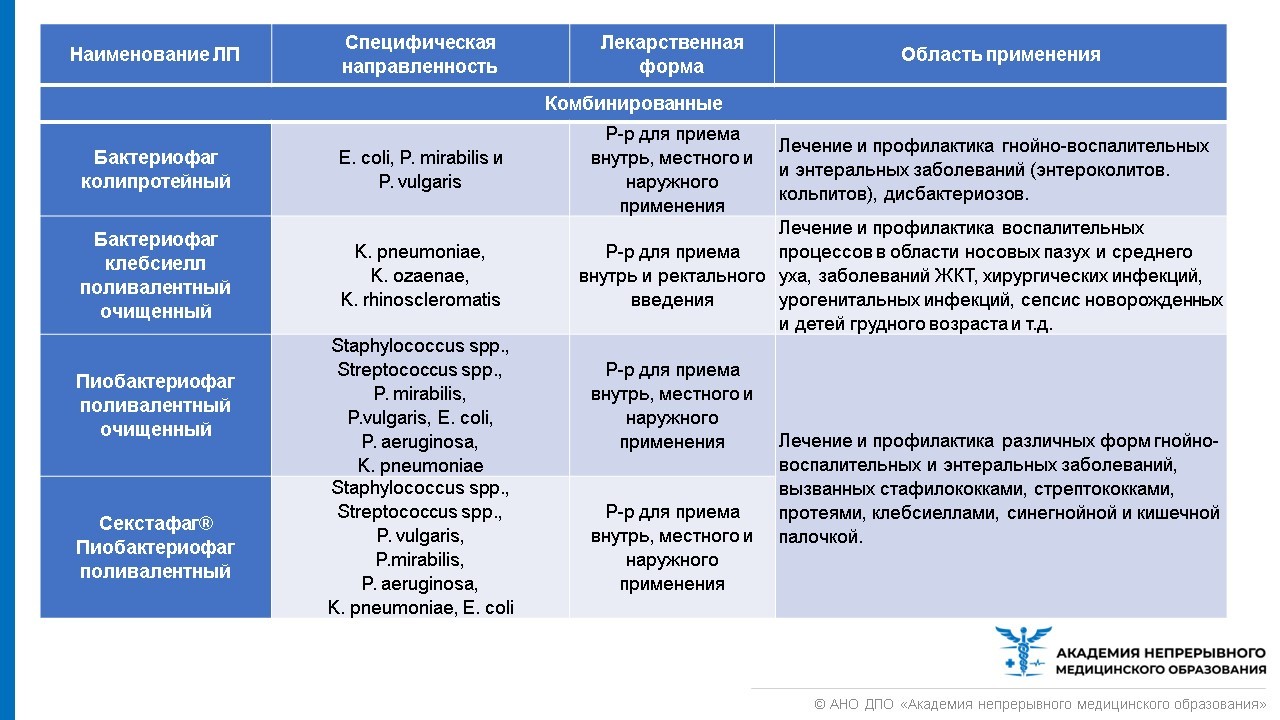
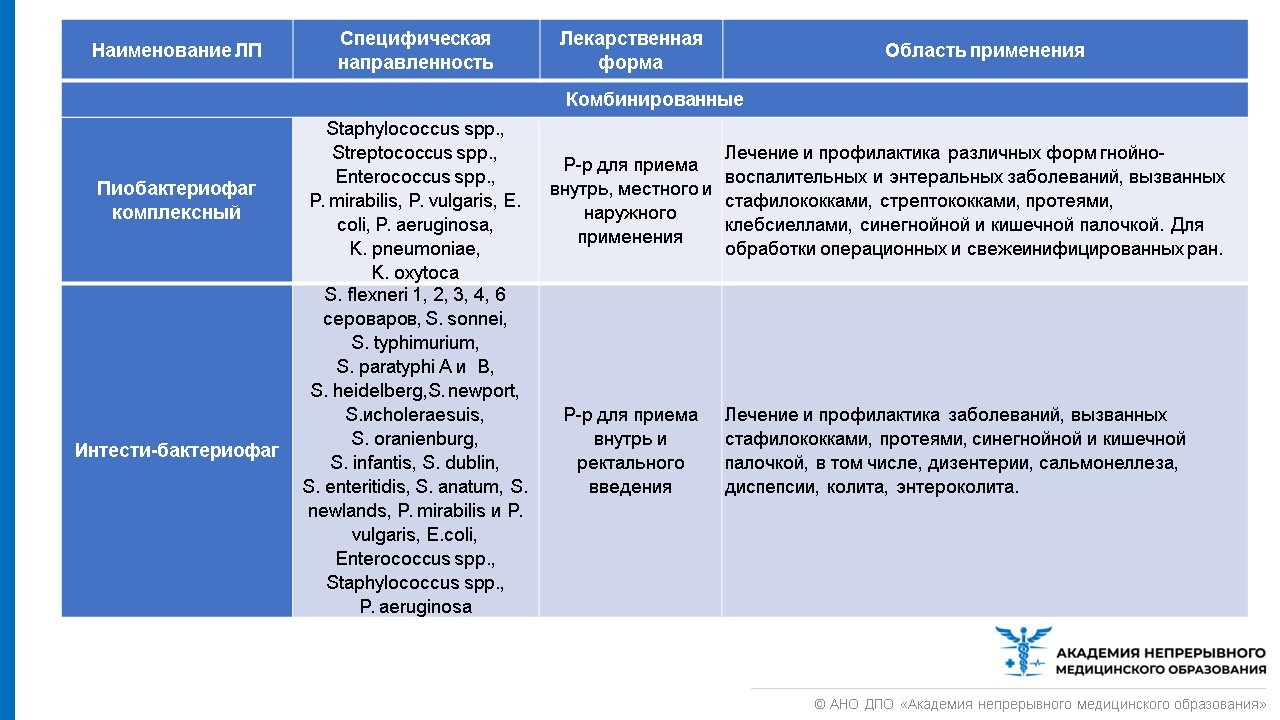
Лечебно-профилактические бактериофаги, область их применения представлены в таблице ниже.
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ - БАКТЕРИОФАГИ
Единственным производителем бактериофагов – лекарственных препаратов в России является АО «НПО «Микроген». Бактериофаги других производителей в России на сегодняшний момент в качестве лекарственных препаратов не зарегистрированы.
Отечественное производство бактериофагов базируется на следующих критериях:
- препараты должны включать только вирулентные бактериофаги;
- фаги, входящие в препарат, должны обладать высокими показателями активности репликации;
- фаги, входящие в препарат, должны сохранять литическую активность при длительном хранении;
- фаги, входящие в препарат, не должны взаимодействовать с представителями облигатной симбиотической микробиоты человека.
АО «НПО «Микроген» производит лекарственные препараты бактериофагов, предназначенные для борьбы с инфекционными заболеваниями, вызванными патогенными и условно-патогенными возбудителями. Эти препараты представляют собой стерильные фильтраты фаголизатов соответствующих видов бактерий, очищенные от эндо- и экзотоксинов, продуктов фаголизиса бактериальных клеток, а также их антигенных комплексов и компонентов питательных сред.
Организация производства лечебно-профилактических бактериофагов осуществляется согласно действующим государственным санитарным правилам с учетом требований системы обеспечения качества надлежащей практики производства. В производственных условиях для изготовления препарата бактериофага применяются только апробированные штаммы бактериофагов (маточные бактериофаги) и культуры соответствующих микробов (производственные штаммы бактерий-продуцентов), обладающих типичными морфологическими, биохимическими и серологическими свойствами.
Бактериофаги проходят контроль на стерильность, безвредность (аномальную токсичность) и литическую активность (вирулентность).
Стерильность бактериофага проверяют обычными способами согласно Государственной фармакопеи. Безвредность препарата проверяют путем его введения белым мышам подкожно. Наблюдение за животными ведется в течение 2 суток; если препарат безвреден, мыши должны оставаться живыми и бодрыми. Литическая активность бактериофага, его вирулентность определяются методом титрования на жидкой и плотной питательной среде. За титр бактериофага при определении методом Аппельмана принимают то наибольшее разведение его, которое вызывает полное растворение соответствующих микробов.
Современные лечебно-профилактические бактериофаги представляют собой комплекс поликлональных бактериальных вирусов, обладающих высокой литической активностью в отношении наиболее эпидемиологически значимых групп возбудителей бактериальных инфекций (бактерий сем. Enterobacteriaceae, родов Staphylococcus, Streptococcus, Pseudomonas и пр.). Бактериофаги выпускают в виде растворов и таблеток. Способы применения – аппликационный, орошение, введение в полости, ректально и перорально.
Парентеральный путь введения сейчас не используется, так как он приводит к развитию иммунного ответа на чужеродный фаговый белок.
Лечебно-профилактические бактериофаги, область их применения представлены в таблице ниже.

В АО «НПО «Микроген» ведется разработка первого в мире бактериофага в капсулах для лечения и профилактики заболеваний, вызываемых бактериями рода стафилококков, стрептококков, протеи, клебсиеллы и кишечной палочки. Также, предприятие проводит клиническое исследование бактериофага, действие которого направленно на борьбу с синегнойной палочкой и бактериями рода ацинетобактер – наиболее частыми возбудителями внутрибольничных инфекций.
ТРЕБОВАНИЯ ПРИ ОБРАЩЕНИИ БАКТЕРИОФАГОВ В АПТЕКАХ
Бактериофаги относятся к группе биологических препаратов (пункт 6.2 статьи 4 закона от 12.04.2010 г. № 61-ФЗ, статья ОФС.1.7.1.0010.18). Обращаем Ваше внимание, что бактериофаги согласно действующим нормативным документам не являются иммунобиологическими лекарственными препаратами (пункт 7 статьи 4 закона от 12.04.2010 г. № 61-ФЗ, статья ОФС.1.7.1.0018.18), то есть на них не распространяются требования санитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и хранения иммунобиологических лекарственных препаратов", утвержденных постановлением главного государственного санитарного врача РФ от 17.02.2016 N 19. Но в инструкциях на некоторые лекарственные препараты – бактериофаги ещё есть указания, что это МИБП (устаревшее название «медицинские иммунобиологические препараты»), что не соответствует действующим нормативным документам.
В Государственную фармакопею РФ ХIV издания включена общая фармакопейная статья ОФС.1.7.1.0002.15 Бактериофаги (вошла без изменений из ГФ XIII издания), которая является базовой для препаратов этой группы. В ОФС Бактериофаги приведены основные требования к порядку производства и требования к качеству лекарственных препаратов бактериофагов, обусловливающих их эффективность и безопасность, приведена современная классификация лечебно-профилактических бактериофагов. Кроме того, в ГФ XIV включены фармакопейные статьи на конкретные бактериофаги.
Бактериофаги являются термолабильными лекарственными препаратами и требуют условий хранения от 2 ⁰С до 8 ⁰С, в защищенном от света месте. При этом допускаются условия транспортировки при температуре от 9 до 25°С не более 1 месяца. Поставщики должны подтвердить соблюдение условий транспортировки и предоставить в аптеку показания термоиндикаторов, если транспортировка осуществлялась в термоконтейнерах или показания терморегистраторов, если использовались авторефрижераторы. Если же температурный режим при перевозке был в диапазоне от 9 до 25°С, то поставщик должен подтвердить, что длительность такого периода не превышала 1 месяца
При приемочном контроле бактериофагов, как и всех других ЛП, проверяют соответствие поступивших препаратов данным в товарно-сопроводительных документах (наименование, количество, серии, сроки годности). Кроме того, необходимо проверить наличие поступивших ЛП в базе данных Росздравнадзора о приостановленных или изъятых из обращения ЛП (электронный сервис «Поиск изъятых из обращения лекарственных средств» на сайте Росздравнадзора). Далее проводят визуальный осмотр поступивших бактериофагов, проверяют целостность упаковки, соответствие маркировки, а также наличие сведений о введении в гражданский оборот поступивших сериях бактериофагов (электронный сервис «Сведения о лекарственных средствах, поступивших в гражданский оборот в РФ» на сайте Росздравнадзора). До 29.11.2019 г соответствие бактериофагов подтверждалось декларацией о соответствии.
При несоответствии поступивших бактериофагов показателям приемочного контроля, их перемещают в карантинную зону, выделенную в холодильнике, и возвращают поставщику или передают на уничтожение.
В процессе хранения бактериофагов необходимо осуществлять их контроль качества. Ежедневно проводить мониторинг информационных писем Росздравнадзора о приостановлении, прекращении обращения, отзыве из обращения ЛП на официальном сайте Росздравнадзора и осуществлять проверку наличия указанных серий (партий) ЛП в аптеке. При выявлении в аптеке серий (партий) бактериофагов, обращение которых приостановлено или принято решение об их изъятии из обращения, необходимо переместить данные ЛП в зону карантинного хранения (при приостановлении обращения), выделенную в холодильнике, или в зону хранения выявленных фальсифицированных, недоброкачественных, контрафактных ЛП, лекарственных препаратов с истекшим сроком годности с последующей передачей их на уничтожение или возвратом поставщику.
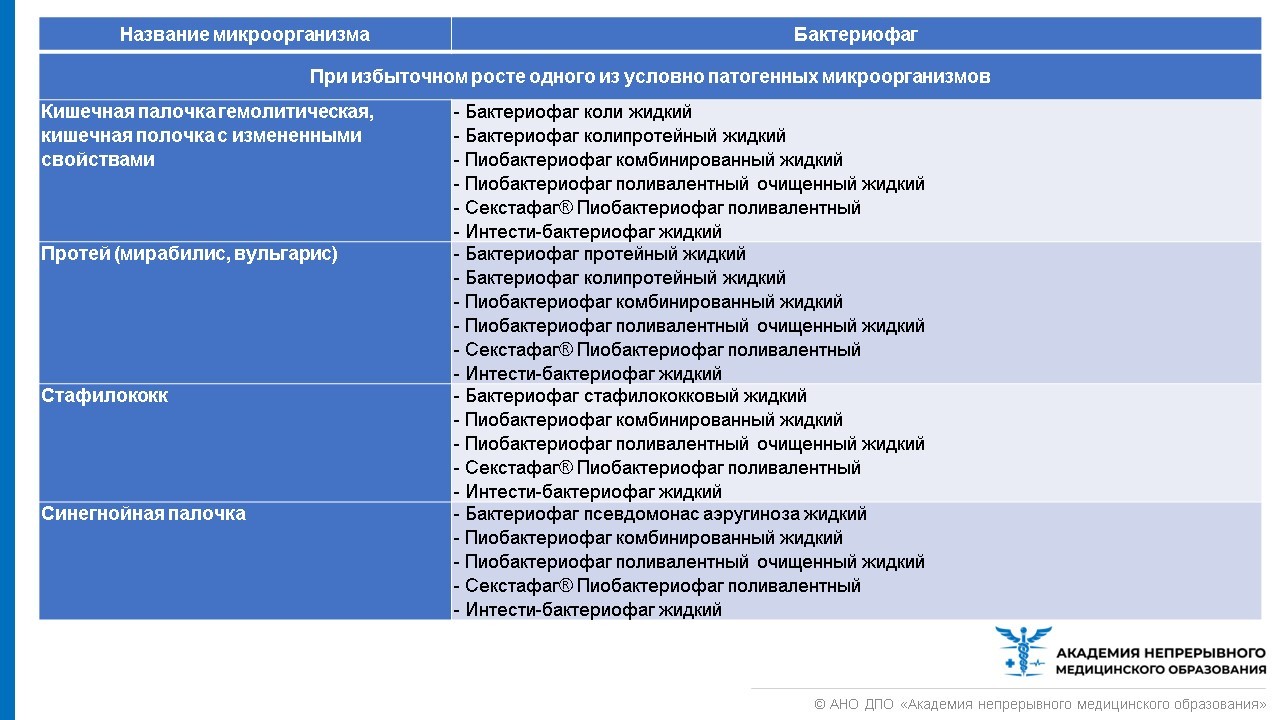
В настоящее время все бактериофаги отпускаются из аптеки без рецепта. Но покупать препарат бактериофага, чтобы лечиться самостоятельно, все же не стоит. При выборе препарата из группы бактериофагов необходимо руководствоваться лабораторной постановкой чувствительности возбудителя инфекции к бактериофагу. Назначить лечение и выбрать лекарство должен врач. Стандартная схема выбора бактериофагов представлена в таблице ниже.
ТРЕБОВАНИЯ ПРИ ОБРАЩЕНИИ БАКТЕРИОФАГОВ В АПТЕКАХ
Бактериофаги относятся к группе биологических препаратов (пункт 6.2 статьи 4 закона от 12.04.2010 г. № 61-ФЗ, статья ОФС.1.7.1.0010.18). Обращаем Ваше внимание, что бактериофаги согласно действующим нормативным документам не являются иммунобиологическими лекарственными препаратами (пункт 7 статьи 4 закона от 12.04.2010 г. № 61-ФЗ, статья ОФС.1.7.1.0018.18), то есть на них не распространяются требования санитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и хранения иммунобиологических лекарственных препаратов", утвержденных постановлением главного государственного санитарного врача РФ от 17.02.2016 N 19. Но в инструкциях на некоторые лекарственные препараты – бактериофаги ещё есть указания, что это МИБП (устаревшее название «медицинские иммунобиологические препараты»), что не соответствует действующим нормативным документам.
В Государственную фармакопею РФ ХIV издания включена общая фармакопейная статья ОФС.1.7.1.0002.15 Бактериофаги (вошла без изменений из ГФ XIII издания), которая является базовой для препаратов этой группы. В ОФС Бактериофаги приведены основные требования к порядку производства и требования к качеству лекарственных препаратов бактериофагов, обусловливающих их эффективность и безопасность, приведена современная классификация лечебно-профилактических бактериофагов. Кроме того, в ГФ XIV включены фармакопейные статьи на конкретные бактериофаги.
Бактериофаги являются термолабильными лекарственными препаратами и требуют условий хранения от 2 ⁰С до 8 ⁰С, в защищенном от света месте. При этом допускаются условия транспортировки при температуре от 9 до 25°С не более 1 месяца. Поставщики должны подтвердить соблюдение условий транспортировки и предоставить в аптеку показания термоиндикаторов, если транспортировка осуществлялась в термоконтейнерах или показания терморегистраторов, если использовались авторефрижераторы. Если же температурный режим при перевозке был в диапазоне от 9 до 25°С, то поставщик должен подтвердить, что длительность такого периода не превышала 1 месяца
При приемочном контроле бактериофагов, как и всех других ЛП, проверяют соответствие поступивших препаратов данным в товарно-сопроводительных документах (наименование, количество, серии, сроки годности). Кроме того, необходимо проверить наличие поступивших ЛП в базе данных Росздравнадзора о приостановленных или изъятых из обращения ЛП (электронный сервис «Поиск изъятых из обращения лекарственных средств» на сайте Росздравнадзора). Далее проводят визуальный осмотр поступивших бактериофагов, проверяют целостность упаковки, соответствие маркировки, а также наличие сведений о введении в гражданский оборот поступивших сериях бактериофагов (электронный сервис «Сведения о лекарственных средствах, поступивших в гражданский оборот в РФ» на сайте Росздравнадзора). До 29.11.2019 г соответствие бактериофагов подтверждалось декларацией о соответствии.
При несоответствии поступивших бактериофагов показателям приемочного контроля, их перемещают в карантинную зону, выделенную в холодильнике, и возвращают поставщику или передают на уничтожение.
В процессе хранения бактериофагов необходимо осуществлять их контроль качества. Ежедневно проводить мониторинг информационных писем Росздравнадзора о приостановлении, прекращении обращения, отзыве из обращения ЛП на официальном сайте Росздравнадзора и осуществлять проверку наличия указанных серий (партий) ЛП в аптеке. При выявлении в аптеке серий (партий) бактериофагов, обращение которых приостановлено или принято решение об их изъятии из обращения, необходимо переместить данные ЛП в зону карантинного хранения (при приостановлении обращения), выделенную в холодильнике, или в зону хранения выявленных фальсифицированных, недоброкачественных, контрафактных ЛП, лекарственных препаратов с истекшим сроком годности с последующей передачей их на уничтожение или возвратом поставщику.
В настоящее время все бактериофаги отпускаются из аптеки без рецепта. Но покупать препарат бактериофага, чтобы лечиться самостоятельно, все же не стоит. При выборе препарата из группы бактериофагов необходимо руководствоваться лабораторной постановкой чувствительности возбудителя инфекции к бактериофагу. Назначить лечение и выбрать лекарство должен врач. Стандартная схема выбора бактериофагов представлена в таблице ниже.

КОСМЕТИЧЕСКИЕ СРЕДСТВА С БАКТЕРИОФАГАМИ
Помимо лекарственных препаратов в аптеке могут быть косметические средства с бактериофагами: Фагогин – гель для интимной гигиены; Фагодерм – гель для проблемной кожи; Гель-бальзам с бактериофагами Линии MIRRA PROPHYLACTIC – бальзам при ссадинах и угрях; спреи с бактериофагами серии VA линии Microbiology research; гель-лубрикант увлажняющий Линии "MIRRA INTIM" и др." средства гигиены полости рта: гелевая паста - аппликатор для полости рта, линия "MIRRA DENT" – для предупреждения воспалительных заболеваний полости рта; спреи для полости рта с бактериофагами серии VA линии Microbiology research и др. Обращение этих товарных групп регламентируется Техническим Регламентом таможенного союза 009/2011 «О безопасности парфюмерно-косметической продукции» и Едиными санитарно-эпидемиологическими и гигиеническими требованиями к продукции, подлежащей санитарно-эпидемиологическому надзору, утвержденных Решением Комиссии Таможенного союза от 28.05.2010 г. № 299.
ПЕРСПЕКТИВЫ ДАЛЬНЕЙШЕГО ИСПОЛЬЗОВАНИЯ БАКТЕРИОФАГОВ
В России создан Биологический ресурсный центр для углубленного изучения бактериофагов. Центр должен заниматься изучением свойств бактериофагов, молекулярно-генетическими исследованиями, селекцией. Это позволит расширить области применения бактериофагов, усовершенствовать технологии их производства, разработать новые препараты. Самой амбициозной целью нового центра является создание основы для перехода к персонализированной фаготерапии.
Применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов. Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин.
Помимо лекарственных препаратов в аптеке могут быть косметические средства с бактериофагами: Фагогин – гель для интимной гигиены; Фагодерм – гель для проблемной кожи; Гель-бальзам с бактериофагами Линии MIRRA PROPHYLACTIC – бальзам при ссадинах и угрях; спреи с бактериофагами серии VA линии Microbiology research; гель-лубрикант увлажняющий Линии "MIRRA INTIM" и др." средства гигиены полости рта: гелевая паста - аппликатор для полости рта, линия "MIRRA DENT" – для предупреждения воспалительных заболеваний полости рта; спреи для полости рта с бактериофагами серии VA линии Microbiology research и др. Обращение этих товарных групп регламентируется Техническим Регламентом таможенного союза 009/2011 «О безопасности парфюмерно-косметической продукции» и Едиными санитарно-эпидемиологическими и гигиеническими требованиями к продукции, подлежащей санитарно-эпидемиологическому надзору, утвержденных Решением Комиссии Таможенного союза от 28.05.2010 г. № 299.
ПЕРСПЕКТИВЫ ДАЛЬНЕЙШЕГО ИСПОЛЬЗОВАНИЯ БАКТЕРИОФАГОВ
В России создан Биологический ресурсный центр для углубленного изучения бактериофагов. Центр должен заниматься изучением свойств бактериофагов, молекулярно-генетическими исследованиями, селекцией. Это позволит расширить области применения бактериофагов, усовершенствовать технологии их производства, разработать новые препараты. Самой амбициозной целью нового центра является создание основы для перехода к персонализированной фаготерапии.
Применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов. Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин.
Автор статьи: Лариса Ивановна Гарбузова, доцент кафедры фармакологии и фармации СЗГМУ им. И.И. Мечникова
Полезная статья? Поделитесь в соцсетях:
Остались вопросы? Задайте их в комментариях, и наши эксперты вам ответят: