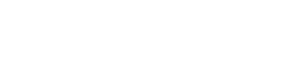Грядущие изменения в Положении о лицензировании фармацевтической деятельности. ФЗ №316-ФЗ
О внесении изменений в Федеральный закон «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» и статью 19 Федерального закона «О лицензировании отдельных видов деятельности.
Статья в формате видеолекции здесь.
Статья в формате видеолекции здесь.
С 14 августа 2018 года вступили в силу изменения, внесенные Федеральным законом №316-ФЗ. В связи с этим рассмотрим подробнее, что именно изменилось в фармацевтической деятельности, на что следует обратить внимание, и какие предпосылки для дальнейших изменений данный Федеральный закон вносит.
Указанные изменения напрямую связаны с реформой контрольно-надзорной деятельности, начавшейся еще в 2017 году (данная тема освещалась в предыдущих наших статьях и касалась списка контрольных вопросов (чек-листов) в рамках риск-ориентированной модели контрольно-надзорной деятельности).
Ключевая фраза, которая появляется в части 1 статьи 19 Федерального закона №99-ФЗ «О лицензировании отдельных видов деятельности»: «Порядок организации и осуществления лицензионного контроля за конкретным видом деятельности устанавливается Положением о лицензировании конкретного вида деятельности, утвержденным Правительством Российской Федерации».
То есть те изменения, которые произойдут в Положении о лицензировании фармацевтической деятельности, и утвердят порядок организации и осуществления лицензионного контроля.
Напоминаем, что государственный контроль (надзор) в сфере обращения лекарственных средств делится на:
- выборочный контроль качества лекарственных средств;
- федеральный государственный надзор в сфере обращения лекарственных средств;
- лицензионный контроль в сфере производства лекарственных средств и фармацевтической деятельности (в рамках которого и произошли изменения).
Указанные изменения напрямую связаны с реформой контрольно-надзорной деятельности, начавшейся еще в 2017 году (данная тема освещалась в предыдущих наших статьях и касалась списка контрольных вопросов (чек-листов) в рамках риск-ориентированной модели контрольно-надзорной деятельности).
Ключевая фраза, которая появляется в части 1 статьи 19 Федерального закона №99-ФЗ «О лицензировании отдельных видов деятельности»: «Порядок организации и осуществления лицензионного контроля за конкретным видом деятельности устанавливается Положением о лицензировании конкретного вида деятельности, утвержденным Правительством Российской Федерации».
То есть те изменения, которые произойдут в Положении о лицензировании фармацевтической деятельности, и утвердят порядок организации и осуществления лицензионного контроля.
Напоминаем, что государственный контроль (надзор) в сфере обращения лекарственных средств делится на:
- выборочный контроль качества лекарственных средств;
- федеральный государственный надзор в сфере обращения лекарственных средств;
- лицензионный контроль в сфере производства лекарственных средств и фармацевтической деятельности (в рамках которого и произошли изменения).
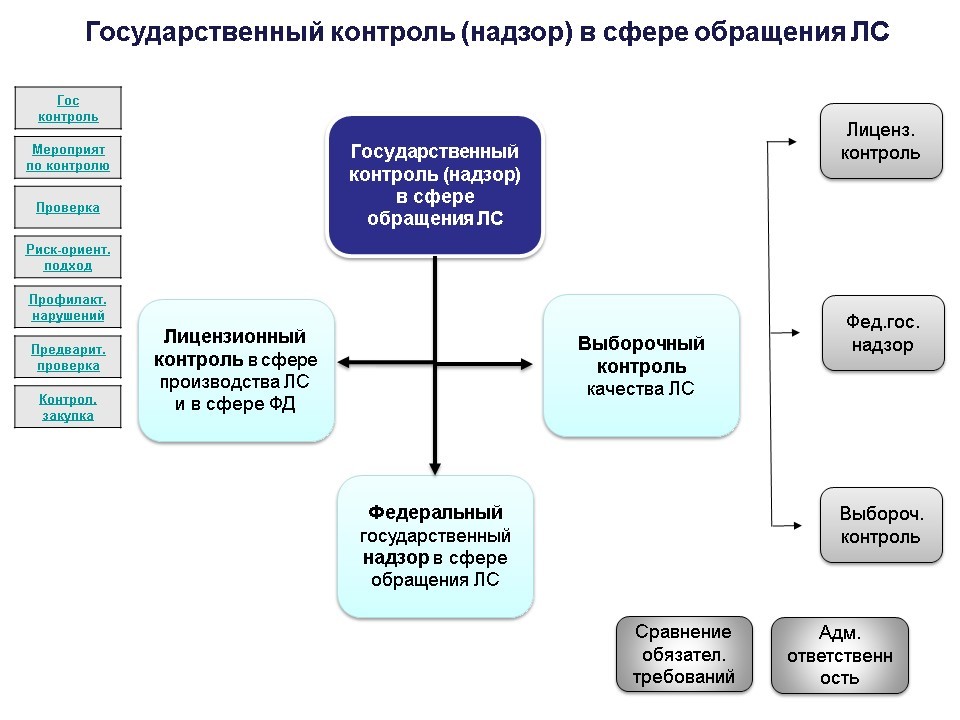
Выборочный контроль качества лекарственных средств в данном случае указанной тематики статьи не касается, поэтому рассматривать его не будем.
Подробнее изучим в сравнении лицензионный контроль и федеральный государственный надзор.
Предметом лицензионного контроля (в соответствии с приказом №585н является соблюдение организациями оптовой торговли лекарственными средствами, аптечными организациями, медицинскими организациями и их обособленными подразделениями, расположенными в сельских населенных пунктах, в которых отсутствуют аптечные организации, и индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, лицензионных требований, установленных Положением о лицензировании фармацевтической деятельности, утвержденным постановлением Правительства РФ от 22 декабря 2011 г. №1081.
Подробнее изучим в сравнении лицензионный контроль и федеральный государственный надзор.
Предметом лицензионного контроля (в соответствии с приказом №585н является соблюдение организациями оптовой торговли лекарственными средствами, аптечными организациями, медицинскими организациями и их обособленными подразделениями, расположенными в сельских населенных пунктах, в которых отсутствуют аптечные организации, и индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, лицензионных требований, установленных Положением о лицензировании фармацевтической деятельности, утвержденным постановлением Правительства РФ от 22 декабря 2011 г. №1081.
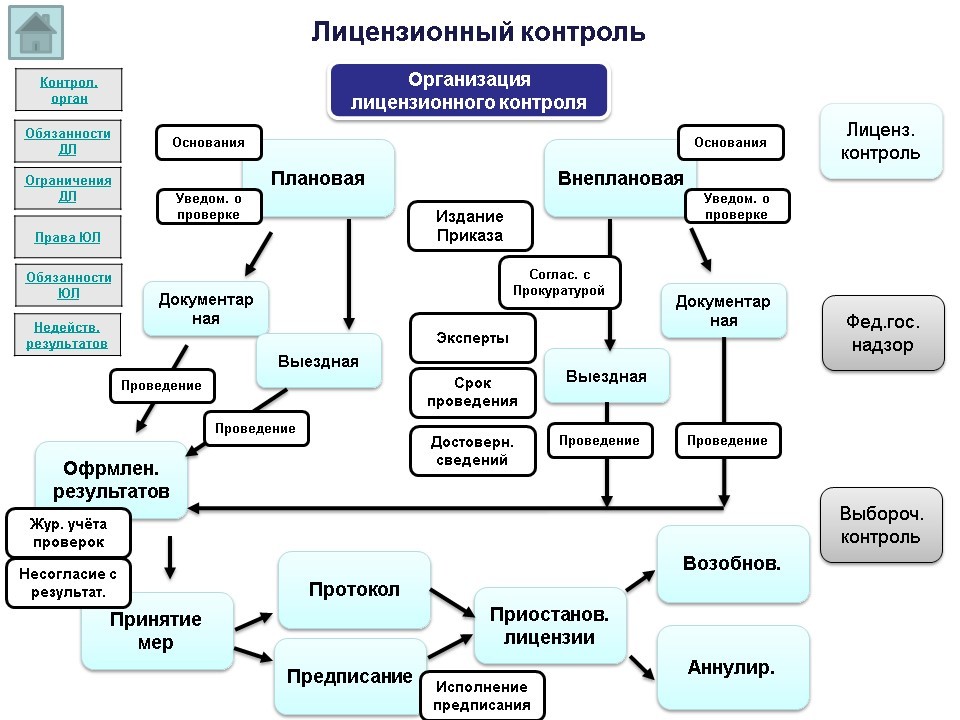
Предметом федерального государственного надзора (согласно Приказу МЗ РФ №998) является организация и проведение проверок соблюдения субъектами обращения лекарственных средств требований к доклиническим исследованиям лекарственных средств, клиническим исследованиям лекарственных препаратов, хранению, перевозке, отпуску, реализации лекарственных средств, применению лекарственных препаратов, уничтожению недоброкачественных, фальсифицированных и контрафактных лекарственных средств.
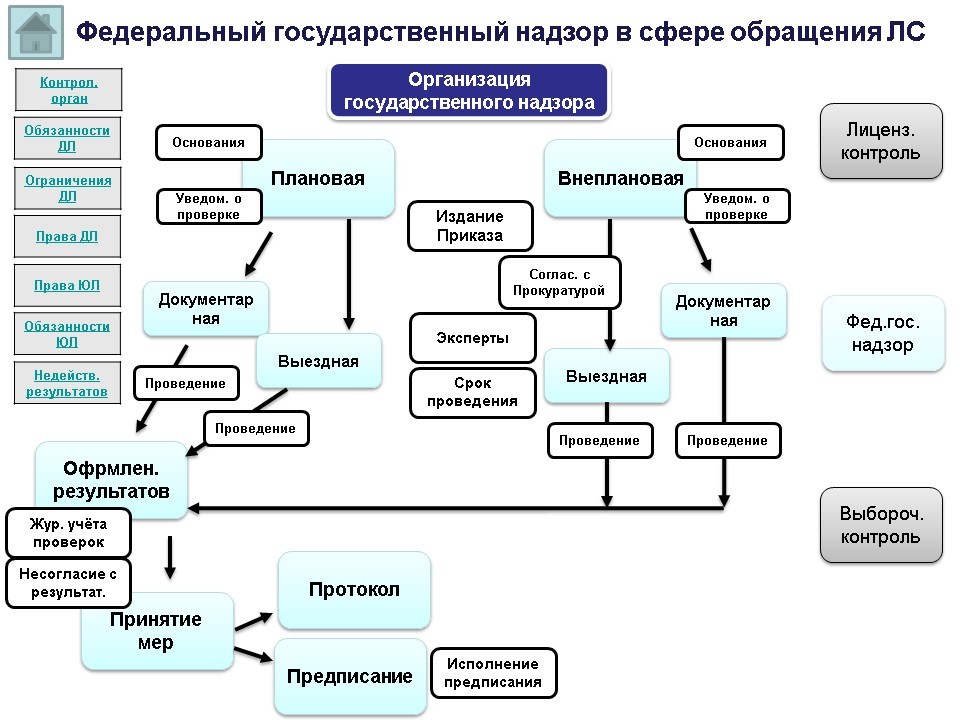
Все изменения, которые сейчас внесены в Федеральный закон №99-ФЗ, произошли в целях обеспечения использования риск-ориентированного подхода при организации лицензионного контроля.
В настоящее время при проведении проверки (если проверка плановая в рамках федерального государственного надзора) учитывается уровень риска (значительный/средний/умеренный/низкий), в соответствии с которым установлена частота проведения проверки и определен список контрольных вопросов.
В то время как в рамках лицензионного контроля не предусмотрено разделение на риски и использование проверочных листов (если от контролирующего органа пришел приказ на проведение проверки в рамках лицензионного контроля, проверочных листов (со списком контрольных вопросов) в данном случае не будет). По этой причине проведение проверок в рамках лицензионного контроля сейчас также подводится к необходимости использования риск-ориентированного подхода.
В настоящее время при проведении проверки (если проверка плановая в рамках федерального государственного надзора) учитывается уровень риска (значительный/средний/умеренный/низкий), в соответствии с которым установлена частота проведения проверки и определен список контрольных вопросов.
В то время как в рамках лицензионного контроля не предусмотрено разделение на риски и использование проверочных листов (если от контролирующего органа пришел приказ на проведение проверки в рамках лицензионного контроля, проверочных листов (со списком контрольных вопросов) в данном случае не будет). По этой причине проведение проверок в рамках лицензионного контроля сейчас также подводится к необходимости использования риск-ориентированного подхода.
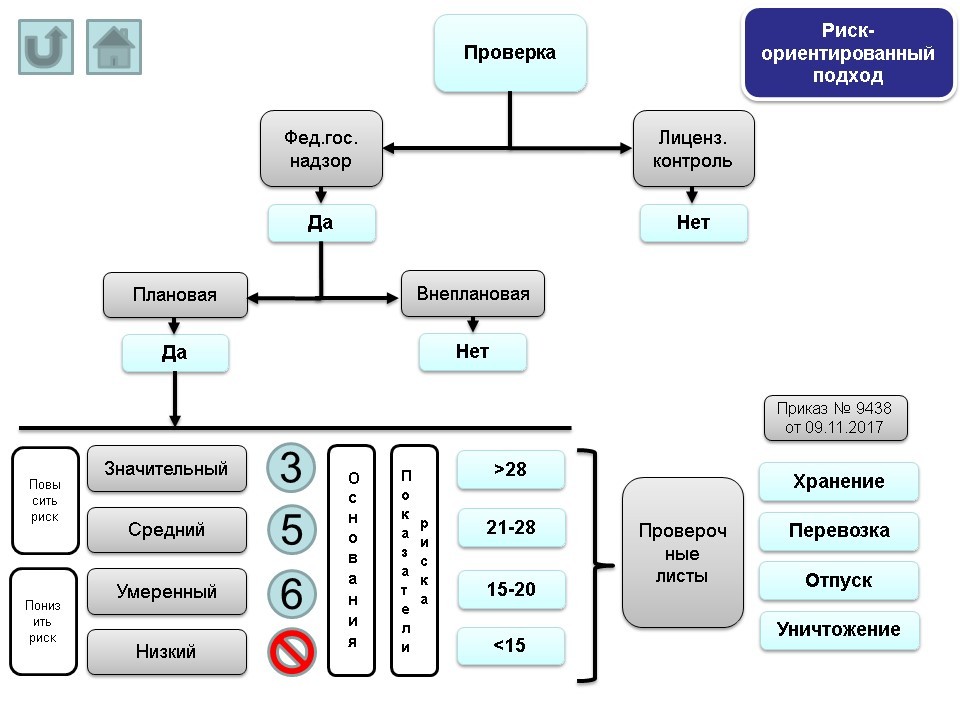
Если обратиться к проектам нормативных документов, связанных с лицензионным контролем, можно найти проект по внесению изменений в Положение о лицензировании фармацевтической деятельности, утвержденное постановлением Правительства РФ от 22 декабря 2011 г. №1081, а именно: плановые проверки лицензиатов будут проводиться при осуществлении федерального государственного надзора в сфере обращения лекарственных средств.
Таким образом, в Положение о лицензировании фармацевтической деятельности планируется включить условие, что проведение плановых проверок будет проходить в рамках федерального государственного надзора. То есть лицензионный контроль будет также подпадать под риск-ориентированную модель.
На данный момент включение в план проверок в рамках федерального государственного надзора той или иной организации зависит от уровня риска (если организация относится к низкому риску, в отношении нее проверка в рамках федерального государственного надзора проводиться не будет); что касается лицензионного контроля, организация может попасть в план проверок независимо от уровня риска.
Подведем итог: если данный проект по внесению изменений в Положение о лицензировании фармацевтической деятельности, утвержденное постановлением Правительства РФ от 22 декабря 2011 г. №1081, вступит в силу, то в случае проведения проверки в рамках лицензионного контроля также будет применяться риск-ориентированный подход, и, если организация относится к низкой категории риска, плановая проверка в отношении нее не будет проводиться ни в рамках федерального государственного надзора, ни в рамках лицензионного контроля.
Таким образом, в Положение о лицензировании фармацевтической деятельности планируется включить условие, что проведение плановых проверок будет проходить в рамках федерального государственного надзора. То есть лицензионный контроль будет также подпадать под риск-ориентированную модель.
На данный момент включение в план проверок в рамках федерального государственного надзора той или иной организации зависит от уровня риска (если организация относится к низкому риску, в отношении нее проверка в рамках федерального государственного надзора проводиться не будет); что касается лицензионного контроля, организация может попасть в план проверок независимо от уровня риска.
Подведем итог: если данный проект по внесению изменений в Положение о лицензировании фармацевтической деятельности, утвержденное постановлением Правительства РФ от 22 декабря 2011 г. №1081, вступит в силу, то в случае проведения проверки в рамках лицензионного контроля также будет применяться риск-ориентированный подход, и, если организация относится к низкой категории риска, плановая проверка в отношении нее не будет проводиться ни в рамках федерального государственного надзора, ни в рамках лицензионного контроля.
Полезная статья? Поделитесь в соцсетях:
Остались вопросы? Задайте их в комментариях, и наши эксперты вам ответят: