Обращение медицинских изделий в розничных фармацевтических сетях
Рассмотрим основные вопросы нормативно-правовового регулирования обращения медицинских изделий
На данный момент, к сожалению, нет единого Федерального закона, который регулировал бы обращение медицинских изделий. Тем не менее, определение термину «медицинские изделия» дано в Федеральном законе №323-ФЗ «Об основах охраны здоровья граждан».
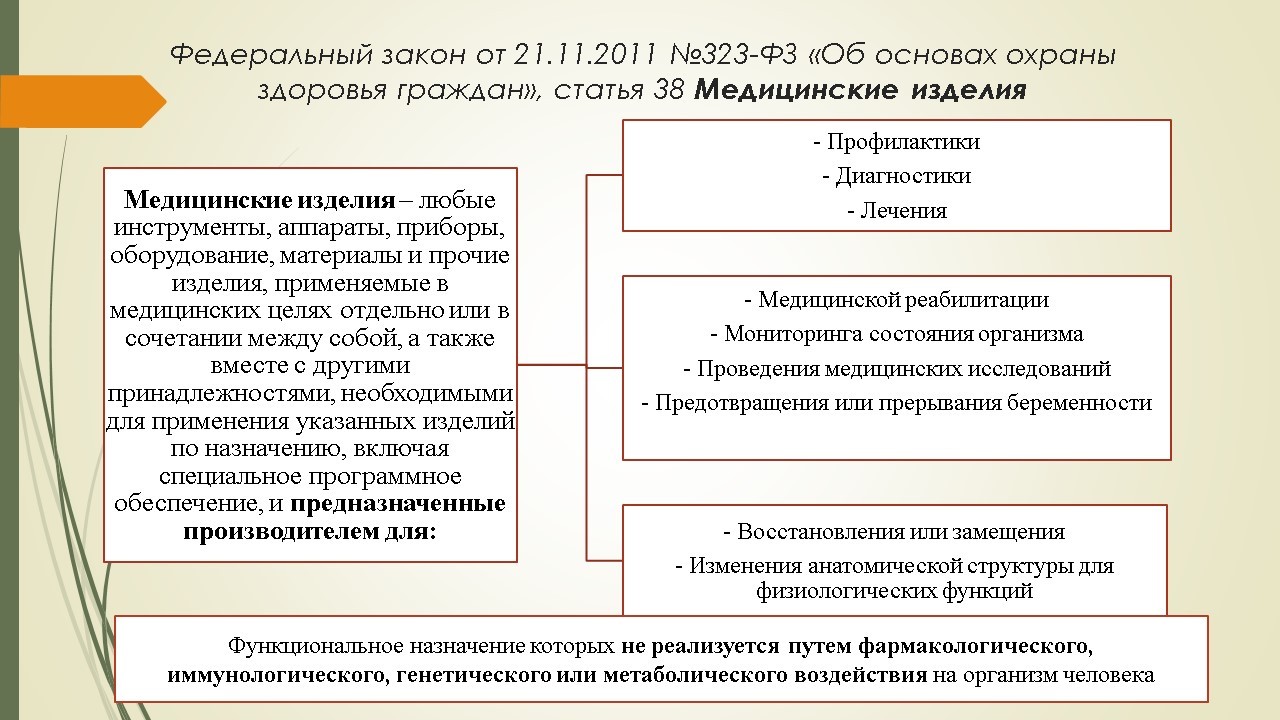
С 2016 года появился еще один нормативный документ, регламентирующий перечень нормативно-правовых актов, регулирующих оборот медицинских изделий, который используется при проведении проверок надзорным органом – Приказ Росздравнадзора №4043 "Об утверждении Перечня правовых актов и их отдельных частей (положений), содержащих обязательные требования, соблюдение которых оценивается при проведении мероприятий по контролю в рамках отдельного вида государственного контроля (надзора)». Нас интересуют пункт 3 и 11 данного Приказа. Для розничных фармацевтических организаций наиболее важным является пункт11, который содержит 19 нормативных актов (Федеральные законы, постановления Правительства, ведомственные приказы).

Пункт 3 предназначен для медицинских организаций, по своему составу содержит большую часть тех же нормативных актов, что и пункт 11 и при этом включает в себя особенности, касающиеся, например, организации клинических исследований, применения и эксплуатации.

На данный момент обращение медицинских изделий, как вид предпринимательской деятельности, требует предварительного уведомления Росздравнадзора, что регламентировано Постановлением Правительства РФ №584 «Об уведомительном порядке начала осуществления отдельных видов предпринимательской деятельности», а также Федеральным законом №294 «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»: уведомление представляется после государственной регистрации и постановки на учет в налоговом органе до начала фактического выполнения работ или предоставления услуг (может быть в форме электронного документа).
За непредоставление указанного уведомления предусмотрена административная ответственность в виде наложения штрафа на должностное лицо в размере от 3 до 5 тыс.р., на юридическое лицо – от 10 до 20 тыс.р. (ч. 1 ст. 19.7.5 КоАП РФ).
За непредоставление указанного уведомления предусмотрена административная ответственность в виде наложения штрафа на должностное лицо в размере от 3 до 5 тыс.р., на юридическое лицо – от 10 до 20 тыс.р. (ч. 1 ст. 19.7.5 КоАП РФ).

Однако следует отметить, что предоставлять данное уведомление обязаны только те розничные фармацевтические организации, которые стали заниматься указанным видом деятельности позднее 18 декабря 2014 года (те, кто начал свою деятельность до указанной даты, освобождаются от уведомления).
Рассмотрим нормативно-правовое регулирование обращения медицинских изделий в разрезе основных процессов, которые происходят в розничной фармацевтической организации от момента поступления медицинского изделия до момента реализации конечному потребителю (отпуска) или уничтожения.
Рассмотрим нормативно-правовое регулирование обращения медицинских изделий в разрезе основных процессов, которые происходят в розничной фармацевтической организации от момента поступления медицинского изделия до момента реализации конечному потребителю (отпуска) или уничтожения.
1. Приемка медицинских изделий.
Сама схема приемки медицинских изделий укладывается в общую схему приемки всех товаров аптечного ассортимента. Основные моменты, касающиеся порядка проведения приемочного контроля изложены в Приказе 647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». Весь процесс начинается с проверки соблюдения условий транспортировки, соответствия поступивших медицинских изделий данным в сопроводительных документах (очень важно в данном случае проверить наличие их в информационных базах данных о приостановлении или изъятии из обращения медицинских изделий).
Сама схема приемки медицинских изделий укладывается в общую схему приемки всех товаров аптечного ассортимента. Основные моменты, касающиеся порядка проведения приемочного контроля изложены в Приказе 647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». Весь процесс начинается с проверки соблюдения условий транспортировки, соответствия поступивших медицинских изделий данным в сопроводительных документах (очень важно в данном случае проверить наличие их в информационных базах данных о приостановлении или изъятии из обращения медицинских изделий).
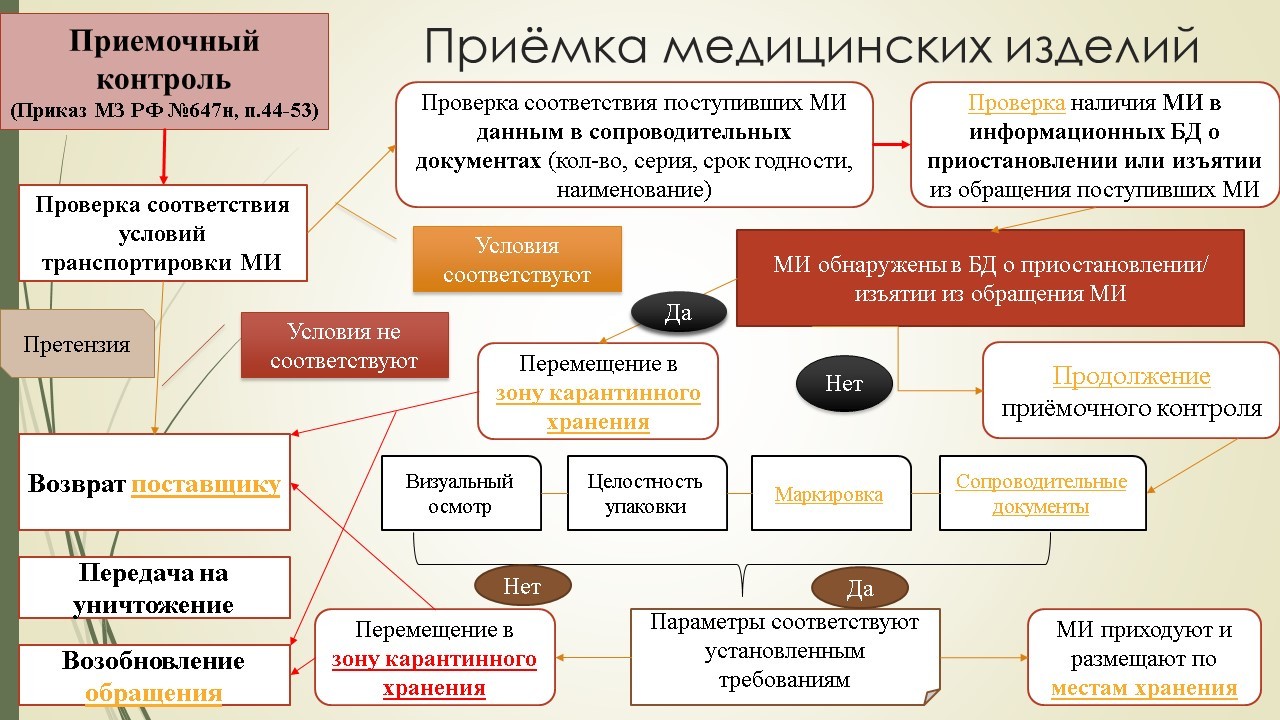
После проверки наличия поступивших медицинских изделий в указанных информационных базах данных и выявления положительного результата необходимо переместить медицинское изделие в зону карантинного хранения. При отрицательном результате приемочный контроль продолжается и будет состоять из следующих стадий: контроль качества, визуальный осмотр, целостность упаковки, маркировка и проверка сопроводительной документации.
Если по перечисленным параметрам медицинское изделие соответствует установленным требованиям, оно приходуется и размещается на основное место хранения; если нет – перемещается в зону карантинного хранения и либо возвращается поставщику (на условиях, прописанных в договоре) и уничтожается, либо возвращается в обращение (если поступила информация о возобновлении обращения).
Рассмотрим подробнее информационные базы данных о фальсифицированных, контрафактных и недоброкачественных медицинских изделиях.
На официальном сайте Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор) есть раздел «Медицинские изделия» (подраздел «Контроль за обращением медицинских изделий», электронный сервис «Информационные письма о медицинских изделиях»).
Если по перечисленным параметрам медицинское изделие соответствует установленным требованиям, оно приходуется и размещается на основное место хранения; если нет – перемещается в зону карантинного хранения и либо возвращается поставщику (на условиях, прописанных в договоре) и уничтожается, либо возвращается в обращение (если поступила информация о возобновлении обращения).
Рассмотрим подробнее информационные базы данных о фальсифицированных, контрафактных и недоброкачественных медицинских изделиях.
На официальном сайте Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор) есть раздел «Медицинские изделия» (подраздел «Контроль за обращением медицинских изделий», электронный сервис «Информационные письма о медицинских изделиях»).

Если на этом этапе выясняется наличие медицинского изделия в базе данных, согласно Федеральному закону №323 «Об основах охраны здоровья граждан» оно не имеет права реализовываться и в дальнейшем фальсифицированные и недоброкачественные медицинские изделия подлежат изъятию и уничтожению или вывозу, а контрафактные – изъятию и только последующему уничтожению.
Порядок уничтожения регламентирован Постановлением Правительства №1360 «Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий».
Порядок уничтожения регламентирован Постановлением Правительства №1360 «Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий».

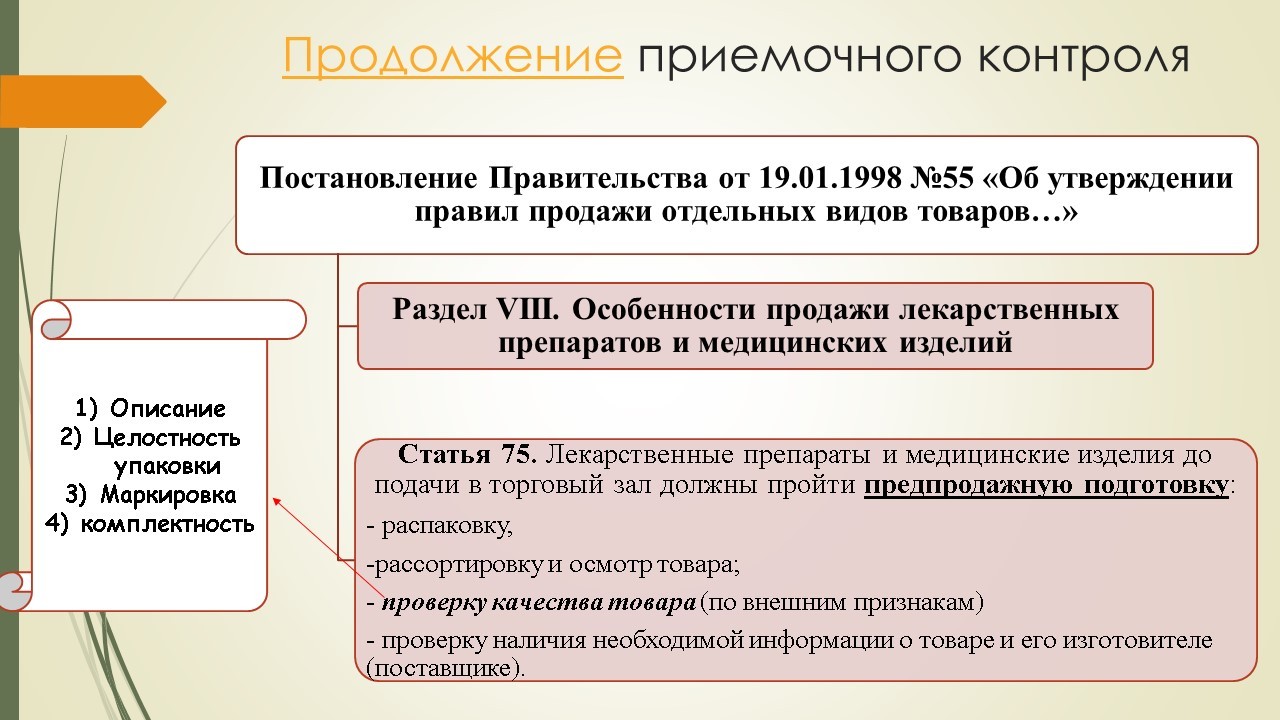
Что касается приемочного контроля, перечень манипуляций, которые необходимо провести до момента передачи изделия на место постоянного хранения, изложен в Постановлении Правительства №55 «Об утверждении правил продажи отдельных видов товаров…». Согласно статье 75 данного Постановления, медицинские изделия до подачи в торговый зал должны пройти предпродажную подготовку:
- распаковку;
- рассортировку и осмотр товара;
- проверку качества товара (по внешним признакам: описание, целостность упаковки, маркировка, комплектность);
- проверку наличия необходимой информации о товаре и его изготовителе (поставщике).
- распаковку;
- рассортировку и осмотр товара;
- проверку качества товара (по внешним признакам: описание, целостность упаковки, маркировка, комплектность);
- проверку наличия необходимой информации о товаре и его изготовителе (поставщике).
Один из параметров качества медицинского изделия – маркировка (именно этот параметр требует особого разъяснения, так как на данный момент нет единого нормативного документа, который содержал бы совокупную информацию о том, какая маркировка на медицинских изделиях должна быть).
Первый нормативный документ, регламентирующий маркировку – Постановление Правительства №1037 «О мерах по обеспечению наличия на ввозимых на территорию РФ непродовольственных товарах информации на русском языке», который говорит о том, что все ввозимые на территорию Российской Федерации и предназначенные для дальнейшей реализации медицинские изделия должны содержать определенный перечень данных на русском языке, а также указывает, где данная информация должна присутствовать.
Первый нормативный документ, регламентирующий маркировку – Постановление Правительства №1037 «О мерах по обеспечению наличия на ввозимых на территорию РФ непродовольственных товарах информации на русском языке», который говорит о том, что все ввозимые на территорию Российской Федерации и предназначенные для дальнейшей реализации медицинские изделия должны содержать определенный перечень данных на русском языке, а также указывает, где данная информация должна присутствовать.

Так как Российская Федерация входит в Таможенный Союз, необходимо помнить о документах, регламентирующих его деятельность: Решение Комиссии Таможенного союза от №299 «О применении санитарных мер в таможенном союзе», в котором также присутствует информация о требованиях к маркировке.

В настоящее время активно создается нормативная база обращения медицинских изделий в рамках Евразийского экономического союза. Основным документом является "Соглашение о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники)" (Заключено в г. Москве 23.12.2014), согласно которому медицинские изделия, прошедшие установленные в рамках Союза процедуры регистрации и подтверждения соответствия общим требованиям безопасности и эффективности медицинских изделий, требованиям к внедрению и поддержанию системы менеджмента качества медицинских изделий, перед выпуском в обращение в рамках Союза подлежат обязательной маркировке специальным знаком обращения медицинского изделия на рынке Союза; данный знак был утвержден в 2016 году Решением Совета Евразийской экономической комиссии N 26 "О специальном знаке обращения медицинских изделий на рынке Евразийского экономического союза".

Также хотелось бы обратить внимание на ряд других документов, в соответствии с которыми осуществляется обращение медицинских изделий в рамках Евразийского экономического союза:

Что касается Рекомендаций Коллегии Евразийской экономической комиссии №17, в приложении к данному документу указан перечень стандартов (ГОСТ), в результате применения которых на добровольной основе полностью или частично обеспечивается соблюдение соответствия медицинских изделий общим требованиям безопасности и эффективности медицинских изделий, требованиям к их маркировке и эксплуатационной документации на них, а также дата начала применения стандарта и дата прекращения.
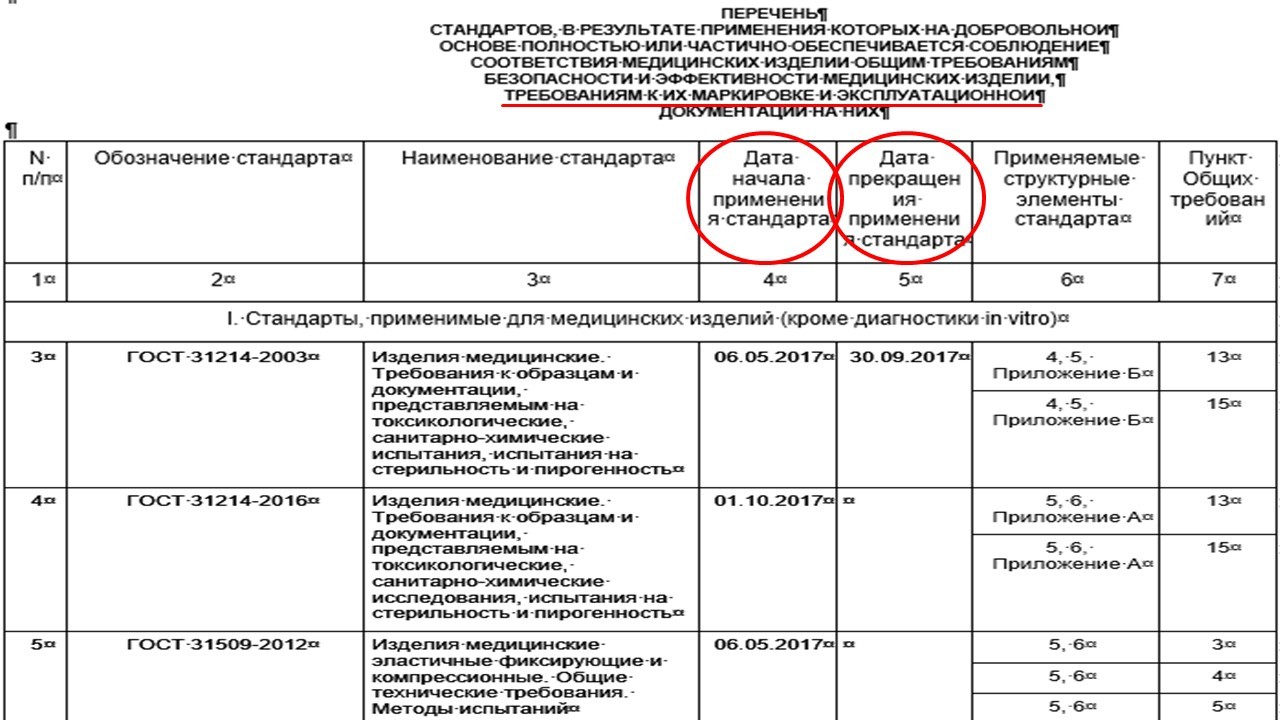
Также хотелось бы обратить внимание на еще один документ - Решение Совета Евразийской экономической комиссии №30, который посвящен порядку формирования и ведения единой информационной системы в сфере обращения медицинских изделий. В п. 14 Раздела II документа присутствует информация о перечне сведений, которые должны быть указаны в данной информационной системе:
«Единый реестр содержит следующие сведения:
у) изображение маркировки медицинского изделия (в электронном виде)»
«Единый реестр содержит следующие сведения:
у) изображение маркировки медицинского изделия (в электронном виде)»
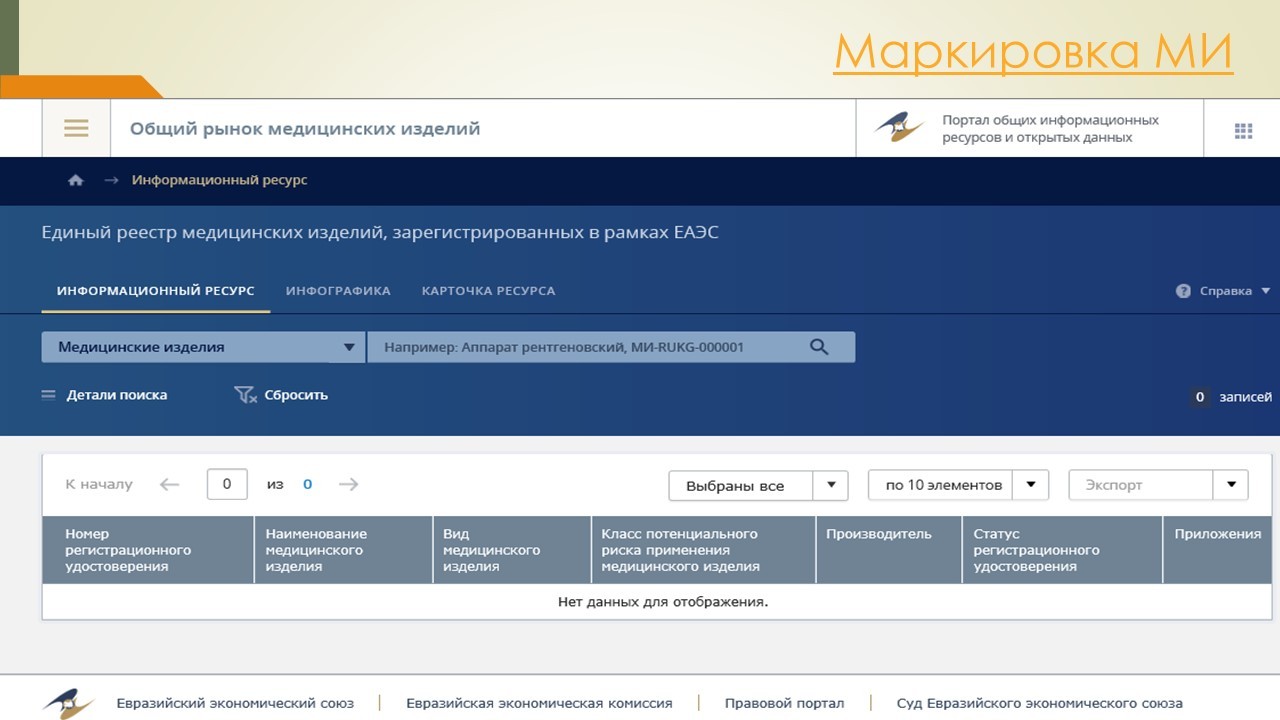
Далее рассмотрим нормативные акты, регламентирующие сопроводительные документы к медицинским изделиям.
В целом данные нормативные акты можно разделить на две группы:
- касающиеся порядка регистрации информации, которая должна присутствовать и которую мы должны предоставлять потребителю;
- касающиеся подтверждения соответствия поступающих медицинских изделий.
Согласно Постановлению Правительства №55 «Об утверждении Правил продажи отдельных видов товаров…», на медицинское изделие должна быть предоставлена информация о номере и дате регистрационного удостоверения.
В целом данные нормативные акты можно разделить на две группы:
- касающиеся порядка регистрации информации, которая должна присутствовать и которую мы должны предоставлять потребителю;
- касающиеся подтверждения соответствия поступающих медицинских изделий.
Согласно Постановлению Правительства №55 «Об утверждении Правил продажи отдельных видов товаров…», на медицинское изделие должна быть предоставлена информация о номере и дате регистрационного удостоверения.

В соответствии со ст. 38 Федерального закона №323 «Об основах охраны здоровья граждан» на территории РФ запрещается реализация медицинских изделий, не зарегистрированных в установленном порядке; исключением являются медицинские изделия, изготовленные по индивидуальному заказу. Порядок регистрации утвержден Постановлением Правительства №1416 "Об утверждении правил государственной регистрации МИ», согласно которому процесс регистрации осуществляется Росздравнадзором, а документом, подтверждающим факт регистрации, является регистрационное удостоверение (выдающееся на данный момент бессрочно).

Найти информацию о регистрационном удостоверении на конкретное медицинское изделие можно на сайте Росздравнадзора в разделе «Медицинские изделия», подразделе «Контроль за обращением медицинских изделий», электронный сервис «Государственный реестр медицинских изделий и организаций (ИП), осуществляющих производство и изготовление медицинских изделий».
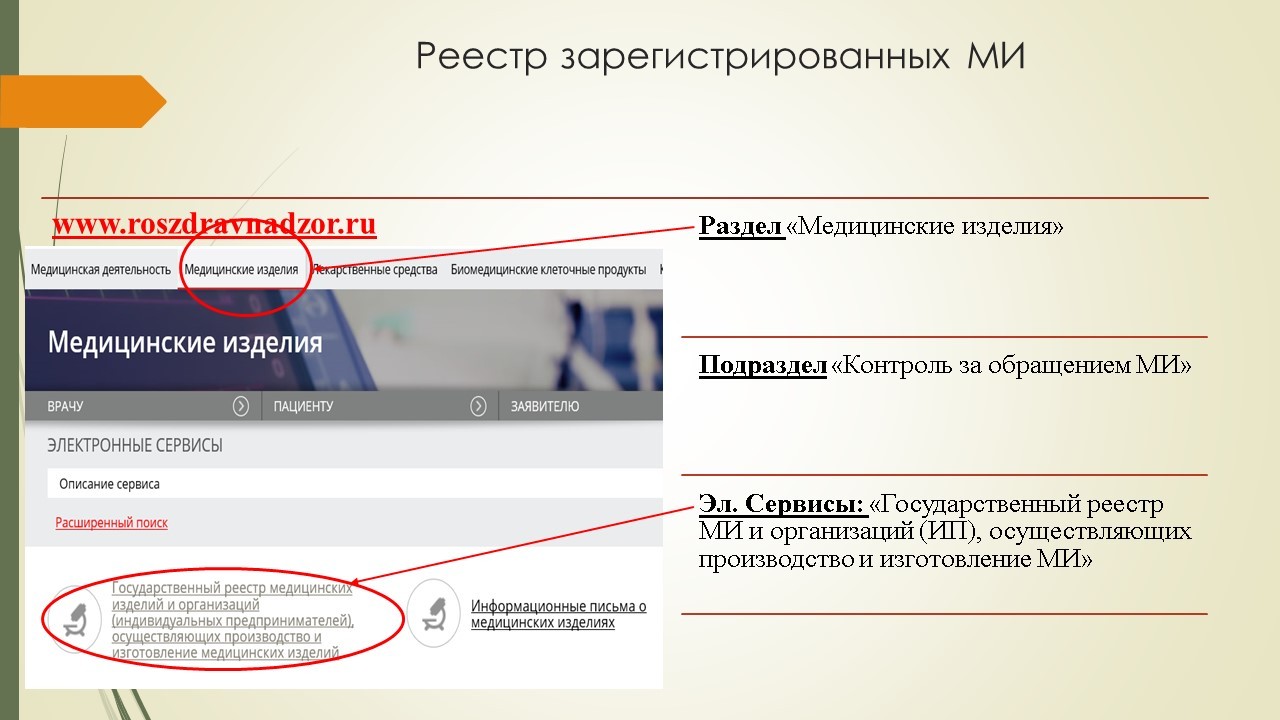
Следует помнить, что регистрационные удостоверения, имеющие ограниченный срок действия и выданные до момента вступления в силу Постановления Правительства №1416 "Об утверждении правил государственной регистрации МИ», действуют до истечения их срока действия.
Регистрационные удостоверения бессрочного действия, выданные до дня вступления в силу настоящего постановления, действительны и подлежат замене до 1 января 2021 г. на регистрационные удостоверения нового образца.
Регистрационные удостоверения бессрочного действия, выданные до дня вступления в силу настоящего постановления, действительны и подлежат замене до 1 января 2021 г. на регистрационные удостоверения нового образца.
Что касается подтверждения соответствия медицинских изделий, оно может быть в виде декларирования соответствия или обязательной сертификации. Конкретные виды медицинских изделий, которые подлежат либо декларированию либо обязательной сертификации можно найти в Постановлении Правительства РФ N 982 "Об утверждении единого перечня продукции, подлежащей обязательной сертификации, и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии».

Обязанность проходить процедуру соответствия возложена ст. 28 Федерального закона № 184-ФЗ «О техническом регулировании».
Заявитель обязан:
- обеспечивать соответствие продукции требованиям технических регламентов;
- выпускать в обращение продукцию, подлежащую обязательному подтверждению соответствия, только после осуществления такого подтверждения соответствия;
- указывать в сопроводительной документации сведения о сертификате соответствия или декларации о соответствии;
- предъявлять в органы государственного контроля (надзора) за соблюдением требований технических регламентов, а также заинтересованным лицам документы, свидетельствующие о подтверждении соответствия продукции требованиям технических регламентов (декларацию о соответствии, сертификат соответствия или их копии) либо регистрационный номер сертификата соответствия или декларации о соответствии.
Заявитель - физическое или юридическое лицо, которое для подтверждения соответствия принимает декларацию о соответствии или обращается за получением сертификата соответствия, получает сертификат соответствия.
Информация, которая должна быть указана в товарно-сопроводительных документах, регламентирована Постановлением Правительства РФ №55 «Об утверждении Правил продажи отдельных видов товаров…»:
- о декларации (регистрационный № декларации, срок её действия, наименование организации, принявшей декларацию и орган, её зарегистрировавший);
- о сертификате (№ сертификата, срок его действия и орган, выдавший сертификат).
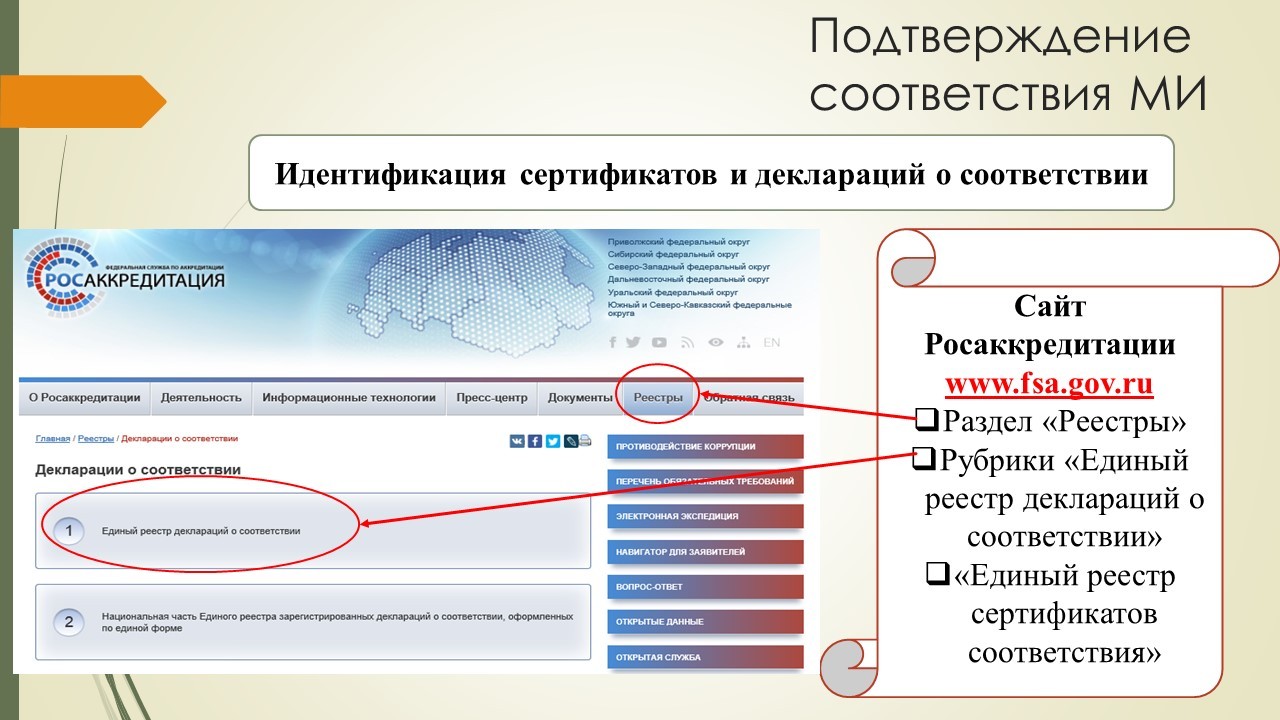
Посмотреть наличие действующей декларации/сертификата можно на сайте РосАккредитации в разделе «Реестры» в рубрике «Единый реестр деклараций о соответствии» либо «Единый реестр сертификатов соответствия».
Заявитель обязан:
- обеспечивать соответствие продукции требованиям технических регламентов;
- выпускать в обращение продукцию, подлежащую обязательному подтверждению соответствия, только после осуществления такого подтверждения соответствия;
- указывать в сопроводительной документации сведения о сертификате соответствия или декларации о соответствии;
- предъявлять в органы государственного контроля (надзора) за соблюдением требований технических регламентов, а также заинтересованным лицам документы, свидетельствующие о подтверждении соответствия продукции требованиям технических регламентов (декларацию о соответствии, сертификат соответствия или их копии) либо регистрационный номер сертификата соответствия или декларации о соответствии.
Заявитель - физическое или юридическое лицо, которое для подтверждения соответствия принимает декларацию о соответствии или обращается за получением сертификата соответствия, получает сертификат соответствия.
Информация, которая должна быть указана в товарно-сопроводительных документах, регламентирована Постановлением Правительства РФ №55 «Об утверждении Правил продажи отдельных видов товаров…»:
- о декларации (регистрационный № декларации, срок её действия, наименование организации, принявшей декларацию и орган, её зарегистрировавший);
- о сертификате (№ сертификата, срок его действия и орган, выдавший сертификат).
Посмотреть наличие действующей декларации/сертификата можно на сайте РосАккредитации в разделе «Реестры» в рубрике «Единый реестр деклараций о соответствии» либо «Единый реестр сертификатов соответствия».
Следует обратить внимание на то, какой существенный штраф предусмотрен за несоблюдение данного требования: согласно ст. 14.45 КоАП РФ, реализация продукции, подлежащей обязательному подтверждению соответствия, без указания в сопроводительной документации сведений о сертификате соответствия или декларации о соответствии, влечет наложение административного штрафа на должностных лиц в размере от двадцати тысяч до сорока тысяч рублей; на юридических лиц - от ста тысяч до трехсот тысяч рублей.

Также следует обратить особое внимание на то, что копии декларации/сертификата, если поставщик не является их держателем, не несут в себе юридической силы и являются лишь информационными листами. Поэтому следует добиваться от поставщика указания в сопроводительной документации данных сведений (в официальном документе, с печатью и подписью).
Согласно ст. 37 Федерального закона №184-ФЗ «О техническом регулировании», изготовитель (исполнитель, продавец, лицо, выполняющее функции иностранного изготовителя), которому стало известно о несоответствии выпущенной в обращение продукции требованиям технических регламентов, обязан сообщить об этом в орган государственного контроля (надзора) в соответствии с его компетенцией в течение десяти дней с момента получения указанной информации.
Согласно ст. 37 Федерального закона №184-ФЗ «О техническом регулировании», изготовитель (исполнитель, продавец, лицо, выполняющее функции иностранного изготовителя), которому стало известно о несоответствии выпущенной в обращение продукции требованиям технических регламентов, обязан сообщить об этом в орган государственного контроля (надзора) в соответствии с его компетенцией в течение десяти дней с момента получения указанной информации.


2. Хранение медицинских изделий.
После осуществления приемочного контроля необходимо разместить медицинские изделия на места их хранения. Хранение медицинских изделий регламентировано Приказом Минздрава РФ №377 "Об утверждении Инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения". Стоит обратить внимание, что данный Приказ не входит в перечень нормативных документов, по которому осуществляет проведение контролирующих мероприятий Росздравнадзор.
После осуществления приемочного контроля необходимо разместить медицинские изделия на места их хранения. Хранение медицинских изделий регламентировано Приказом Минздрава РФ №377 "Об утверждении Инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения". Стоит обратить внимание, что данный Приказ не входит в перечень нормативных документов, по которому осуществляет проведение контролирующих мероприятий Росздравнадзор.

Но интересен тот факт, что в перечне поверочных листов, которые утверждены Приказом Росздравнадзора N 10449 "Об утверждении форм проверочных листов (списков контрольных вопросов), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при проведении плановых проверок при осуществлении государственного контроля за обращением медицинских изделий" в приложении №7 присутствует вопрос №8, звучащий следующим образом: «Осуществляется ли хранение у проверяемой организации в соответствии с разработанной производителем технической и (или) эксплуатационной документацией?», из чего можно сделать вывод, что для проверяющих все-таки основными требованиями, соблюдение которых будет контролироваться, являются требования тех.документации или эксплуатационной документации, обозначенные производителем данного медицинского изделия.
3. Реализация медицинских изделий.
Согласно Приказу № 1181Н «Об утверждении порядка назначения и выписывания медицинских изделий, а также форм рецептурных бланков, на медицинские изделия и порядка оформления указанных бланков, их учета и хранения», утверждены три формы рецептурных бланков на медицинские изделия.
Согласно Приказу № 1181Н «Об утверждении порядка назначения и выписывания медицинских изделий, а также форм рецептурных бланков, на медицинские изделия и порядка оформления указанных бланков, их учета и хранения», утверждены три формы рецептурных бланков на медицинские изделия.

Что касается реализации медицинских изделий, являющихся средствами измерения, в приложении 2 Приказа МЗ РФ №89 «Об утверждении Порядка проведения испытаний в целях утверждения типа средств измерений, а также Перечня медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, в отношении которых проводятся испытания в целях утверждения типа средств измерений» указаны наименования медицинских изделий, относящиеся к средствам измерений.

В соответствии со ст. 13 Федерального закона №102-ФЗ ««Об обеспечении единства измерений», средства измерений, предназначенные для применения в сфере государственного регулирования обеспечения единства измерений, до ввода в эксплуатацию, а также после ремонта подлежат первичной поверке, а в процессе эксплуатации - периодической поверке.
Применяющие средства измерений юридические лица и индивидуальные предприниматели обязаны своевременно представлять эти средства измерений на поверку.
Иногда возникают вопросы, касающиеся тонометров, лежащих на хранении, у которых прошел межповерочный интервал: необходимо ли проводить для них повторную поверку?
Согласно Приказу Минпромторга России №1815 "Об утверждении Порядка проведения поверки средств измерений, требования к знаку поверки и содержанию свидетельства о поверке", периодической поверке подвергается каждый экземпляр средств тзмерений, находящийся в эксплуатации, через установленный межповерочный интервал. Средства измерения, введенные в эксплуатацию и находящиеся на длительном хранении (более одного межповерочного интервала), подвергаются периодической поверке только после окончания хранения.
При вводе в эксплуатацию средства измерения после длительного хранения (более одного межповерочного интервала) проводится периодическая поверка.
Поскольку процесс отпуска все-таки не относится к понятию ввода в эксплуатацию, вопрос о необходимости поверки средства измерения перед отпуском остается открытым.
Применяющие средства измерений юридические лица и индивидуальные предприниматели обязаны своевременно представлять эти средства измерений на поверку.
Иногда возникают вопросы, касающиеся тонометров, лежащих на хранении, у которых прошел межповерочный интервал: необходимо ли проводить для них повторную поверку?
Согласно Приказу Минпромторга России №1815 "Об утверждении Порядка проведения поверки средств измерений, требования к знаку поверки и содержанию свидетельства о поверке", периодической поверке подвергается каждый экземпляр средств тзмерений, находящийся в эксплуатации, через установленный межповерочный интервал. Средства измерения, введенные в эксплуатацию и находящиеся на длительном хранении (более одного межповерочного интервала), подвергаются периодической поверке только после окончания хранения.
При вводе в эксплуатацию средства измерения после длительного хранения (более одного межповерочного интервала) проводится периодическая поверка.
Поскольку процесс отпуска все-таки не относится к понятию ввода в эксплуатацию, вопрос о необходимости поверки средства измерения перед отпуском остается открытым.
4. Возврат медицинских изделий от потребителя.
Что касается возврата медицинских изделий, согласно Постановлению Правительства №55 «Об утверждении Правил продажи отдельных видов товаров…», если медицинские изделия надлежащего качества, возврату они, как и лекарственные средства, не подлежат.
Что касается возврата медицинских изделий, согласно Постановлению Правительства №55 «Об утверждении Правил продажи отдельных видов товаров…», если медицинские изделия надлежащего качества, возврату они, как и лекарственные средства, не подлежат.

В случае отпуска некачественных медицинских изделий, согласно ст. 18 Закона РФ N 2300-1 "О защите прав потребителей", продавец обязан принять товар ненадлежащего качества у потребителя и в случае необходимости провести проверку качества товара. Потребитель вправе участвовать в проверке качества товара.
Однако если в результате экспертизы товара установлено, что его недостатки возникли вследствие обстоятельств, за которые не отвечает продавец, потребитель обязан возместить продавцу расходы на проведение экспертизы, а также связанные с ее проведением расходы на хранение и транспортировку товара.
Кроме того существуют определенные ограничения при продвижении медицинских изделий, также как и лекарственных препаратов: согласно ст. 74 Федерального закона от №323-ФЗ «Об основах охраны здоровья граждан», фармацевтические работники и руководители аптечных организаций не вправе:
- получать от компании, представителя компании образцы лекарственных препаратов, медицинских изделий для вручения населению;
- заключать с компанией, представителем компании соглашения о предложении населению определенных лекарственных препаратов, медицинских изделий;
- предоставлять населению недостоверную и (или) неполную информацию о наличии лекарственных препаратов, включая лекарственные препараты, имеющие одинаковое международное непатентованное наименование, медицинских изделий, в том числе скрывать информацию о наличии лекарственных препаратов и медицинских изделий, имеющих более низкую цену.
Однако если в результате экспертизы товара установлено, что его недостатки возникли вследствие обстоятельств, за которые не отвечает продавец, потребитель обязан возместить продавцу расходы на проведение экспертизы, а также связанные с ее проведением расходы на хранение и транспортировку товара.
Кроме того существуют определенные ограничения при продвижении медицинских изделий, также как и лекарственных препаратов: согласно ст. 74 Федерального закона от №323-ФЗ «Об основах охраны здоровья граждан», фармацевтические работники и руководители аптечных организаций не вправе:
- получать от компании, представителя компании образцы лекарственных препаратов, медицинских изделий для вручения населению;
- заключать с компанией, представителем компании соглашения о предложении населению определенных лекарственных препаратов, медицинских изделий;
- предоставлять населению недостоверную и (или) неполную информацию о наличии лекарственных препаратов, включая лекарственные препараты, имеющие одинаковое международное непатентованное наименование, медицинских изделий, в том числе скрывать информацию о наличии лекарственных препаратов и медицинских изделий, имеющих более низкую цену.
5. Налогообложение при реализации медицинских изделий.
В соответствии со ст. 164 п. 2 пп . 4 Налогового Кодекса Российской Федерации, налог на добавленную стоимость составляет 10%, за исключением медицинских изделий, утвержденных Постановлением Правительства РФ №1042 «Об утверждении перечня медицинских товаров, реализация которых на территории Российской Федерации и ввоз которых на территорию Российской Федерации и иные территории, находящиеся под ее юрисдикцией, не подлежат обложению (освобождаются от обложения) налогом на добавленную стоимость" (они освобождаются от налога на добавленную стоимость).
В соответствии со ст. 164 п. 2 пп . 4 Налогового Кодекса Российской Федерации, налог на добавленную стоимость составляет 10%, за исключением медицинских изделий, утвержденных Постановлением Правительства РФ №1042 «Об утверждении перечня медицинских товаров, реализация которых на территории Российской Федерации и ввоз которых на территорию Российской Федерации и иные территории, находящиеся под ее юрисдикцией, не подлежат обложению (освобождаются от обложения) налогом на добавленную стоимость" (они освобождаются от налога на добавленную стоимость).

6. Регулирование ценообразования.
В ст. 80 Федерального закона №323-ФЗ « Об основах охраны здоровья граждан», утвержден перечень медицинских изделий, в отношении которых государством ведется регулирование ценообразования: предельные отпускные цены производителей и предельные размеры оптовых надбавок к фактическим отпускным ценам на медицинские изделия, включенные в утвержденный Правительством Российской Федерации перечень медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, подлежат государственному регулированию и определяются в порядке, установленном Правительством Российской Федерации №2229-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг».
В ст. 80 Федерального закона №323-ФЗ « Об основах охраны здоровья граждан», утвержден перечень медицинских изделий, в отношении которых государством ведется регулирование ценообразования: предельные отпускные цены производителей и предельные размеры оптовых надбавок к фактическим отпускным ценам на медицинские изделия, включенные в утвержденный Правительством Российской Федерации перечень медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, подлежат государственному регулированию и определяются в порядке, установленном Правительством Российской Федерации №2229-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг».
7. Мониторинг безопасности медицинских изделий.
Что касается мониторинга безопасности медицинских изделий, необходимость его проведения изложена в ст. 96 Федерального закона №323-ФЗ « Об основах охраны здоровья граждан», но основной порядок утвержден Приказом Минздрава №175н «Об утверждении Порядка осуществления мониторинга безопасности медицинских изделий».
Что касается мониторинга безопасности медицинских изделий, необходимость его проведения изложена в ст. 96 Федерального закона №323-ФЗ « Об основах охраны здоровья граждан», но основной порядок утвержден Приказом Минздрава №175н «Об утверждении Порядка осуществления мониторинга безопасности медицинских изделий».




Также данный Приказ утверждает основные сроки рассмотрения Росздравнадзором данного сообщения:

8. Уничтожение медицинских изделий.
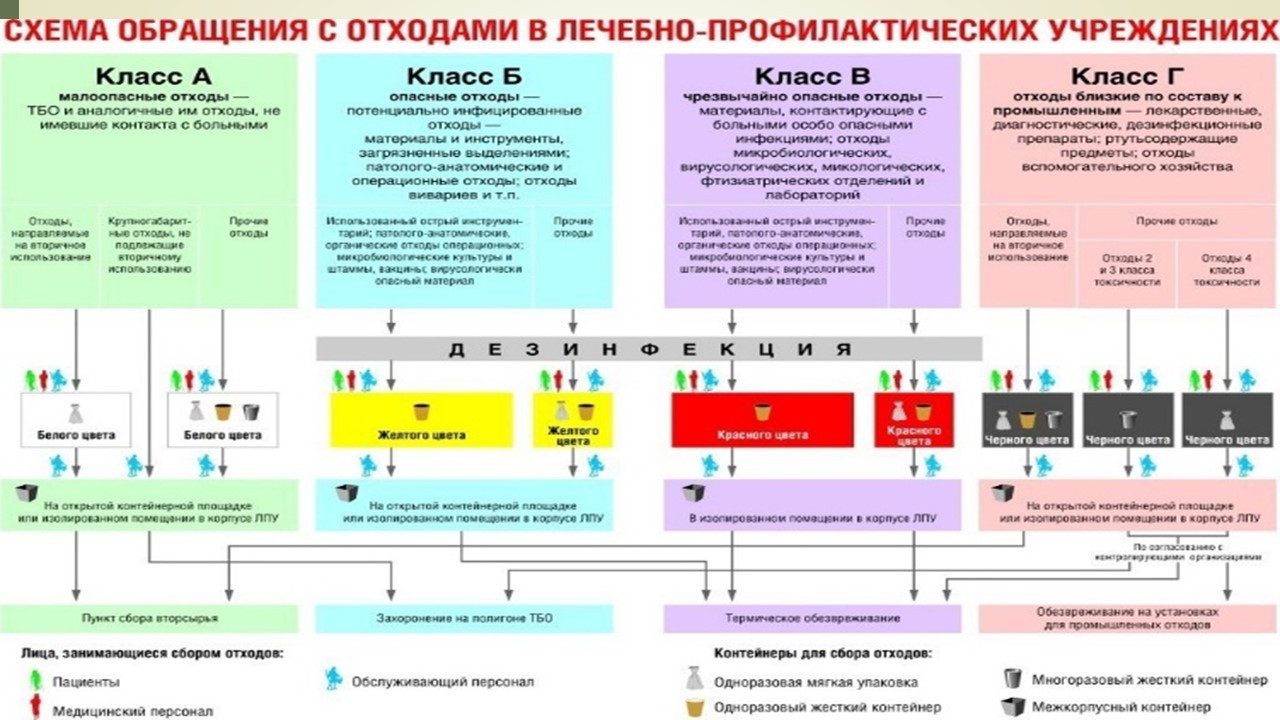
Уничтожение фальсифицированных, недоброкачественных и контрафактных медицинских изделий регламентировано Постановлением Правительства РФ №1360 "Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий", все остальные медицинские изделия будут признаны медицинскими отходами и регулирование их уничтожения осуществляется Постановлением Главного государственного санитарного врача РФ № 163 "Об утверждении СанПиН 2.1.7.2790-10 "Санитарно-эпидемиологические требования к обращению с медицинскими отходами" и Постановлением Главного государственного санитарного врача РФ №144 "О введении в действие СП 2.1.7.1386-03» (вместе с "СП 2.1.7.1386-03. 2.1.7. Почва, очистка населенных мест, отходы производства и потребления. Санитарные правила по определению класса опасности токсичных отходов производства и потребления. Санитарные правила", утв. Главным государственным санитарным врачом РФ 16.06.2003).
Согласно Постановление №163, все медицинские отходы делятся на 5 классов (А, Б, В, Г, Д); медицинские изделия относятся к классу Б, В и Г.
Уничтожение фальсифицированных, недоброкачественных и контрафактных медицинских изделий регламентировано Постановлением Правительства РФ №1360 "Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий", все остальные медицинские изделия будут признаны медицинскими отходами и регулирование их уничтожения осуществляется Постановлением Главного государственного санитарного врача РФ № 163 "Об утверждении СанПиН 2.1.7.2790-10 "Санитарно-эпидемиологические требования к обращению с медицинскими отходами" и Постановлением Главного государственного санитарного врача РФ №144 "О введении в действие СП 2.1.7.1386-03» (вместе с "СП 2.1.7.1386-03. 2.1.7. Почва, очистка населенных мест, отходы производства и потребления. Санитарные правила по определению класса опасности токсичных отходов производства и потребления. Санитарные правила", утв. Главным государственным санитарным врачом РФ 16.06.2003).
Согласно Постановление №163, все медицинские отходы делятся на 5 классов (А, Б, В, Г, Д); медицинские изделия относятся к классу Б, В и Г.



Соответственно в указанном нормативном документе можно найти порядок последовательности действий обращения с данными медицинскими изделиями.
Существуют специализированные организации, которые осуществляют процесс забора медицинских отходов и их дальнейшее уничтожение (например, ООО «Экосервис Поволжья»).
9. Риск-ориентированный подход при проведении проверок.
Согласно Постановлению Правительства РФ №970 "Об утверждении Положения о государственном контроле за обращением медицинских изделий", установлены критерии тяжести потенциальных негативных последствий возможного несоблюдения обязательных требований, в соответствии с которыми осуществляется отнесение той или иной организации к определенной категории риска.
Согласно Постановлению Правительства РФ №970 "Об утверждении Положения о государственном контроле за обращением медицинских изделий", установлены критерии тяжести потенциальных негативных последствий возможного несоблюдения обязательных требований, в соответствии с которыми осуществляется отнесение той или иной организации к определенной категории риска.

В соответствии с указанным Постановлением выделено 4 основных категории риска: значительный, средний, умеренный и низкий. На основании отнесения организации к определенной категории устанавливается кратность проведения плановых проверок контролирующим органом.

Также Приказом Росздравнадзор №10449 "Об утверждении форм проверочных листов (списков контрольных вопросов), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при проведении плановых проверок при осуществлении государственного контроля за обращением медицинских изделий" утверждены формы проверочных листов: приложение 6 – требования при транспортировке, приложение 7 – требования при хранении и реализации.

10. Ответственность, предусмотренная за нарушение требований к обращению медицинских изделий.
За нарушение правил обращения медицинских изделий предусмотрена как административная (отдельные статьи КоАП РФ) так и уголовная ответственность (отдельные статьи УК РФ).
За нарушение правил обращения медицинских изделий предусмотрена как административная (отдельные статьи КоАП РФ) так и уголовная ответственность (отдельные статьи УК РФ).



При подготовке статьи использовались материалы, предоставленные Ларисой Ивановной Гарбузовой, доцентом кафедры УЭФ СЗГМУ им. И.И. Мечникова.
Полезная статья? Поделитесь в соцсетях:
Остались вопросы? Задайте их в комментариях, и наши эксперты вам ответят: