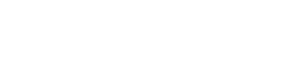Изучение Приказа 585н. Часть 2
Организация проведения проверок аптек Росздравнадзором в рамках новой нормативной документации. Часть 2
Эта статья в формате видеолекции здесь
Эта статья в формате видеолекции здесь
В данной статье рассмотрим подробнее темы, которые не были освещены ранее в 1 части по Приказу 585н (а именно: риск-ориентированный подход при проведении контрольно-надзорных мероприятий и проверочные листы, административная ответственность, предусмотренная за нарушения и профилактика нарушений, понятия контрольная закупка и предварительная проверка).
Риск-ориентированный подход представляет собой метод организации и осуществления государственного контроля (надзора), при котором в предусмотренных Федеральным законом №294 случаях выбор интенсивности (формы, продолжительности, периодичности) проведения мероприятий по контролю, мероприятий по профилактике нарушения обязательных требований определяется отнесением деятельности ЮЛ, ИП и (или) используемых ими при осуществлении такой деятельности производственных объектов к определенной категории риска.
Отнесение к определенной категории риска осуществляется органом государственного контроля (надзора) с учетом тяжести потенциальных негативных последствий возможного несоблюдения ЮЛ, ИП обязательных требований, с учетом оценки вероятности несоблюдения соответствующих обязательных требований.
Риск-ориентированный подход применим только для плановых проверок в рамках федерального государственного надзора.
Риск-ориентированный подход представляет собой метод организации и осуществления государственного контроля (надзора), при котором в предусмотренных Федеральным законом №294 случаях выбор интенсивности (формы, продолжительности, периодичности) проведения мероприятий по контролю, мероприятий по профилактике нарушения обязательных требований определяется отнесением деятельности ЮЛ, ИП и (или) используемых ими при осуществлении такой деятельности производственных объектов к определенной категории риска.
Отнесение к определенной категории риска осуществляется органом государственного контроля (надзора) с учетом тяжести потенциальных негативных последствий возможного несоблюдения ЮЛ, ИП обязательных требований, с учетом оценки вероятности несоблюдения соответствующих обязательных требований.
Риск-ориентированный подход применим только для плановых проверок в рамках федерального государственного надзора.
Существует 4 основные категории риска, и, в зависимости от отнесения организации к определенной категории, устанавливается периодичность проведения плановых проверок в отношении данной организации:
- значительная категория риска – 1 раз в 3 года;
- средняя категория риска – 1 раз в 5 лет;
- умеренная категория риска – 1 раз в 6 лет;
- низкая категория риска – плановые проверки не проводятся.
Отнесение объектов государственного надзора в сфере обращения лекарственных средств для медицинского применения к определенной категории риска осуществляется по решению руководителя (заместителя руководителя) Федеральной службы по надзору в сфере здравоохранения на основании критериев отнесения объектов государственного надзора к определенной категории риска.
На официальном сайте Федеральной службы по надзору в сфере здравоохранения размещается и поддерживается в актуальном состоянии следующая информация об объектах государственного надзора, отнесенных к категории значительного риска, содержащаяся в перечнях:
- категория риска и дата принятия решения об отнесении объекта государственного надзора к категории значительного риска.
ЮЛ или ИП вправе подать заявление об изменении присвоенной ранее их деятельности категории риска.
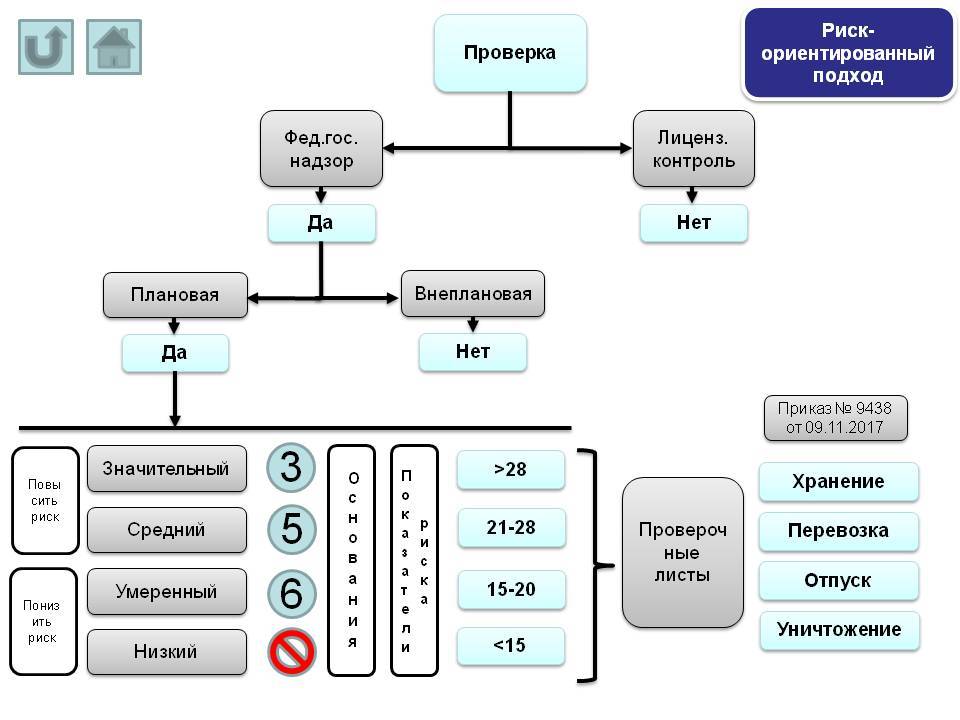
Критерии, в соответствии с которыми организации присваивается та или иная категория риска, регламентированы Постановление Правительства №1043.
В зависимости от суммы баллов этих критериев объект государственного надзора может быть отнесен к определенной категории риска:
- значительная категория риска – >28;
- средняя категория риска – 21-28;
- умеренная категория риска – 15-20;
- низкая категория риска – <15.
Например, сумма баллов все критериев для аптеки готовых лекарственных форм = 19, что относит ее к умеренной категории риска (проведение плановых проверок не чаще 1 раза в 6 лет).
- значительная категория риска – 1 раз в 3 года;
- средняя категория риска – 1 раз в 5 лет;
- умеренная категория риска – 1 раз в 6 лет;
- низкая категория риска – плановые проверки не проводятся.
Отнесение объектов государственного надзора в сфере обращения лекарственных средств для медицинского применения к определенной категории риска осуществляется по решению руководителя (заместителя руководителя) Федеральной службы по надзору в сфере здравоохранения на основании критериев отнесения объектов государственного надзора к определенной категории риска.
На официальном сайте Федеральной службы по надзору в сфере здравоохранения размещается и поддерживается в актуальном состоянии следующая информация об объектах государственного надзора, отнесенных к категории значительного риска, содержащаяся в перечнях:
- категория риска и дата принятия решения об отнесении объекта государственного надзора к категории значительного риска.
ЮЛ или ИП вправе подать заявление об изменении присвоенной ранее их деятельности категории риска.
Критерии, в соответствии с которыми организации присваивается та или иная категория риска, регламентированы Постановление Правительства №1043.
В зависимости от суммы баллов этих критериев объект государственного надзора может быть отнесен к определенной категории риска:
- значительная категория риска – >28;
- средняя категория риска – 21-28;
- умеренная категория риска – 15-20;
- низкая категория риска – <15.
Например, сумма баллов все критериев для аптеки готовых лекарственных форм = 19, что относит ее к умеренной категории риска (проведение плановых проверок не чаще 1 раза в 6 лет).
Стоит обратить внимание, что категория риска для определенной организации может меняться.
Объекты государственного надзора, подлежащие отнесению к категориям среднего, умеренного и низкого рисков, подлежат отнесению к категориям значительного, среднего и умеренного рисков соответственно при наличии вступивших в законную силу в течение 2 лет, предшествующих дате принятия решения об отнесении объекта государственного надзора к категории риска, 2 или более постановлений о привлечении к административной ответственности ЮЛ, его должностных лиц или ИП с назначением административного наказания в виде административного штрафа или административного приостановления деятельности за совершение административных правонарушений, предусмотренных:
а) статьей 6.33 КоАП РФ в части производства, продажи или ввоза на территорию РФ фальсифицированных ЛС, продажи или ввоза на территорию РФ контрафактных ЛС, продажи или ввоза на территорию РФ недоброкачественных ЛС, а также незаконного производства, продажи или ввоза на территорию РФ незарегистрированных ЛС;
б) статьей 14.4.2 КоАП РФ;
в) статьей 14.43 КоАП РФ в части хранения, перевозки и реализации ЛС;
г) статьей 14.44 КоАП РФ в части недостоверного декларирования соответствия ЛС;
д) частью 21 статьи 19.5 КоАП РФ за невыполнение в установленный срок законного предписания федерального органа исполнительной власти, осуществляющего функции по контролю и надзору в сфере здравоохранения, или его территориального органа об устранении выявленных нарушений обязательных требований в сфере обращения лекарственных средств для медицинского применения, касающихся изготовления, перевозки, реализации и хранения ЛС.
Таким образом, если за предшествующие присвоению определенной категории риска 2 года организации было вынесено 1 постановление о привлечении к административной ответственности по какой-либо из перечисленных статей, категория риска не меняется; если вынесенных постановлений (в отношении данной организации) было 2 и более, категория риска повышается.
Обратная ситуация, когда объекты государственного надзора, отнесенные к категориям значительного, среднего и умеренного рисков, подлежат отнесению к категориям среднего, умеренного и низкого рисков соответственно при отсутствии в течение 2 лет, предшествующих дате принятия решения об отнесении объекта государственного надзора к категории риска, вступивших в законную силу постановлений о привлечении к административной ответственности ЮЛ, его должностных лиц или ИП с назначением им административного наказания в виде административного штрафа или административного приостановления их деятельности за совершение административных правонарушений предусмотренных:
а) статьей 6.33 КоАП РФ в части производства, продажи или ввоза на территорию РФ фальсифицированных ЛС, продажи или ввоза на территорию РФ контрафактных ЛС, продажи или ввоза на территорию РФ недоброкачественных ЛС, а также незаконного производства, продажи или ввоза на территорию РФ незарегистрированных ЛС;
б) статьей 14.4.2 КоАП РФ;
в) статьей 14.43 КоАП РФ в части хранения, перевозки и реализации ЛС;
г) статьей 14.44 КоАП РФ в части недостоверного декларирования соответствия ЛС;
д) частью 21 статьи 19.5 КоАП РФ за невыполнение в установленный срок законного предписания федерального органа исполнительной власти, осуществляющего функции по контролю и надзору в сфере здравоохранения, или его территориального органа об устранении выявленных нарушений обязательных требований в сфере обращения лекарственных средств для медицинского применения, касающихся изготовления, перевозки, реализации и хранения ЛС.
Таким образом, если за предшествующие присвоению определенной категории риска 2 года организации не было вынесено ни 1 постановление о привлечении к административной ответственности по какой-либо из перечисленных статей, категория риска понижается.
Что касается проверочных листов, их применение регламентировано Приказом Росздравнадзора от 09.11.2017 № 9438 «Об утверждении форм проверочных листов (списков контрольных вопросов), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при проведении плановых проверок при осуществлении федерального государственного надзора в сфере обращения лекарственных средств».
Должностные лица, уполномоченные осуществлять государственный надзор, при проведении плановой проверки обязаны использовать проверочные листы (списки контрольных вопросов).
Использование проверочных листов (списков контрольных вопросов) осуществляется при проведении плановой проверки всех ЮЛ и ИП.
Проверочные листы (списки контрольных вопросов) содержат вопросы, затрагивающие предъявляемые к ЮЛ и ИП обязательные требования, соблюдение которых является наиболее значимым с точки зрения недопущения возникновения угрозы причинения вреда жизни, здоровью граждан.
Предмет плановой проверки ЮЛ и ИП ограничивается перечнем вопросов, включенных в проверочные листы (списки контрольных вопросов).
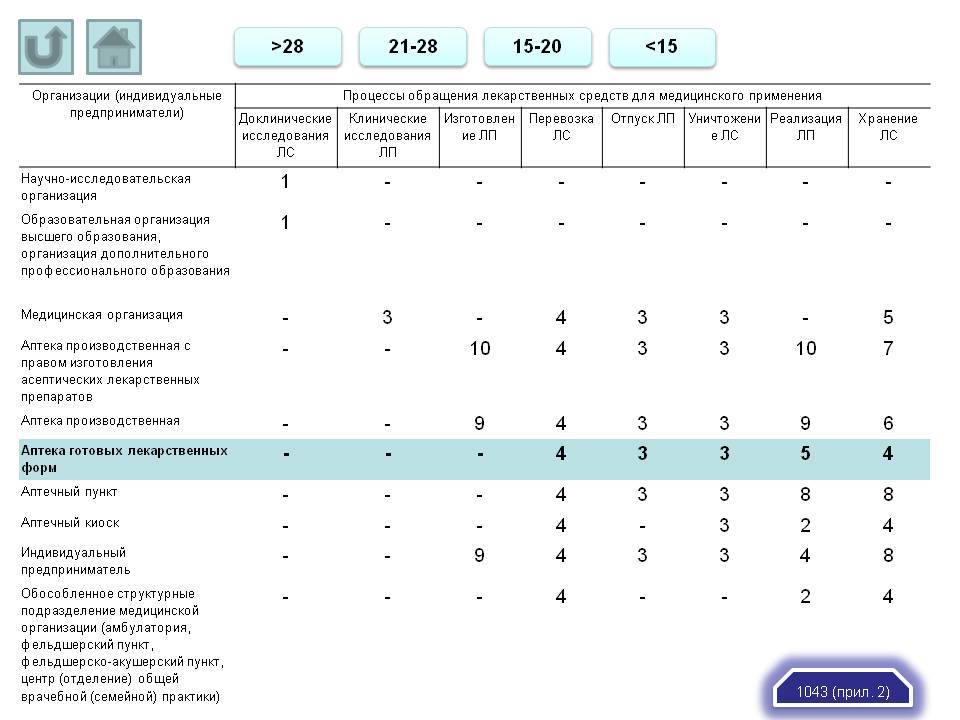
Проверочные листы классифицируются в зависимости от вида организации, к которой они применимы и вида выполняемого действия (хранение, перевозка, отпуск, уничтожение).
Поскольку наибольшее количество вопросов вызвали проверочные листы, связанные именно с хранением лекарственных препаратов, рассмотрим подробнее их.
На приведенной ниже схеме видно, в отношении каких организаций применимо использование проверочных листов, связанных с хранением лекарственных препаратов (организации оптовой торговли, медицинские организации, индивидуальные предприниматели, аптечные пункты, аптечные киоски и т.д.), какие разделы они в себя включают (управление качеством, инфраструктура и оборудование и т.д.), и на какие нормативные документы опирается каждый раздел (Федеральный закон №61, Государственная фармакопея XIII, Приказы 646н, 647н и 706н).
Объекты государственного надзора, подлежащие отнесению к категориям среднего, умеренного и низкого рисков, подлежат отнесению к категориям значительного, среднего и умеренного рисков соответственно при наличии вступивших в законную силу в течение 2 лет, предшествующих дате принятия решения об отнесении объекта государственного надзора к категории риска, 2 или более постановлений о привлечении к административной ответственности ЮЛ, его должностных лиц или ИП с назначением административного наказания в виде административного штрафа или административного приостановления деятельности за совершение административных правонарушений, предусмотренных:
а) статьей 6.33 КоАП РФ в части производства, продажи или ввоза на территорию РФ фальсифицированных ЛС, продажи или ввоза на территорию РФ контрафактных ЛС, продажи или ввоза на территорию РФ недоброкачественных ЛС, а также незаконного производства, продажи или ввоза на территорию РФ незарегистрированных ЛС;
б) статьей 14.4.2 КоАП РФ;
в) статьей 14.43 КоАП РФ в части хранения, перевозки и реализации ЛС;
г) статьей 14.44 КоАП РФ в части недостоверного декларирования соответствия ЛС;
д) частью 21 статьи 19.5 КоАП РФ за невыполнение в установленный срок законного предписания федерального органа исполнительной власти, осуществляющего функции по контролю и надзору в сфере здравоохранения, или его территориального органа об устранении выявленных нарушений обязательных требований в сфере обращения лекарственных средств для медицинского применения, касающихся изготовления, перевозки, реализации и хранения ЛС.
Таким образом, если за предшествующие присвоению определенной категории риска 2 года организации было вынесено 1 постановление о привлечении к административной ответственности по какой-либо из перечисленных статей, категория риска не меняется; если вынесенных постановлений (в отношении данной организации) было 2 и более, категория риска повышается.
Обратная ситуация, когда объекты государственного надзора, отнесенные к категориям значительного, среднего и умеренного рисков, подлежат отнесению к категориям среднего, умеренного и низкого рисков соответственно при отсутствии в течение 2 лет, предшествующих дате принятия решения об отнесении объекта государственного надзора к категории риска, вступивших в законную силу постановлений о привлечении к административной ответственности ЮЛ, его должностных лиц или ИП с назначением им административного наказания в виде административного штрафа или административного приостановления их деятельности за совершение административных правонарушений предусмотренных:
а) статьей 6.33 КоАП РФ в части производства, продажи или ввоза на территорию РФ фальсифицированных ЛС, продажи или ввоза на территорию РФ контрафактных ЛС, продажи или ввоза на территорию РФ недоброкачественных ЛС, а также незаконного производства, продажи или ввоза на территорию РФ незарегистрированных ЛС;
б) статьей 14.4.2 КоАП РФ;
в) статьей 14.43 КоАП РФ в части хранения, перевозки и реализации ЛС;
г) статьей 14.44 КоАП РФ в части недостоверного декларирования соответствия ЛС;
д) частью 21 статьи 19.5 КоАП РФ за невыполнение в установленный срок законного предписания федерального органа исполнительной власти, осуществляющего функции по контролю и надзору в сфере здравоохранения, или его территориального органа об устранении выявленных нарушений обязательных требований в сфере обращения лекарственных средств для медицинского применения, касающихся изготовления, перевозки, реализации и хранения ЛС.
Таким образом, если за предшествующие присвоению определенной категории риска 2 года организации не было вынесено ни 1 постановление о привлечении к административной ответственности по какой-либо из перечисленных статей, категория риска понижается.
Что касается проверочных листов, их применение регламентировано Приказом Росздравнадзора от 09.11.2017 № 9438 «Об утверждении форм проверочных листов (списков контрольных вопросов), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при проведении плановых проверок при осуществлении федерального государственного надзора в сфере обращения лекарственных средств».
Должностные лица, уполномоченные осуществлять государственный надзор, при проведении плановой проверки обязаны использовать проверочные листы (списки контрольных вопросов).
Использование проверочных листов (списков контрольных вопросов) осуществляется при проведении плановой проверки всех ЮЛ и ИП.
Проверочные листы (списки контрольных вопросов) содержат вопросы, затрагивающие предъявляемые к ЮЛ и ИП обязательные требования, соблюдение которых является наиболее значимым с точки зрения недопущения возникновения угрозы причинения вреда жизни, здоровью граждан.
Предмет плановой проверки ЮЛ и ИП ограничивается перечнем вопросов, включенных в проверочные листы (списки контрольных вопросов).
Проверочные листы классифицируются в зависимости от вида организации, к которой они применимы и вида выполняемого действия (хранение, перевозка, отпуск, уничтожение).
Поскольку наибольшее количество вопросов вызвали проверочные листы, связанные именно с хранением лекарственных препаратов, рассмотрим подробнее их.
На приведенной ниже схеме видно, в отношении каких организаций применимо использование проверочных листов, связанных с хранением лекарственных препаратов (организации оптовой торговли, медицинские организации, индивидуальные предприниматели, аптечные пункты, аптечные киоски и т.д.), какие разделы они в себя включают (управление качеством, инфраструктура и оборудование и т.д.), и на какие нормативные документы опирается каждый раздел (Федеральный закон №61, Государственная фармакопея XIII, Приказы 646н, 647н и 706н).
Рассмотрим непосредственно сами вопросы (по разделам), входящие в проверочные листы и необходимые меры подготовки к ним.
I. Управление качеством
I. Управление качеством
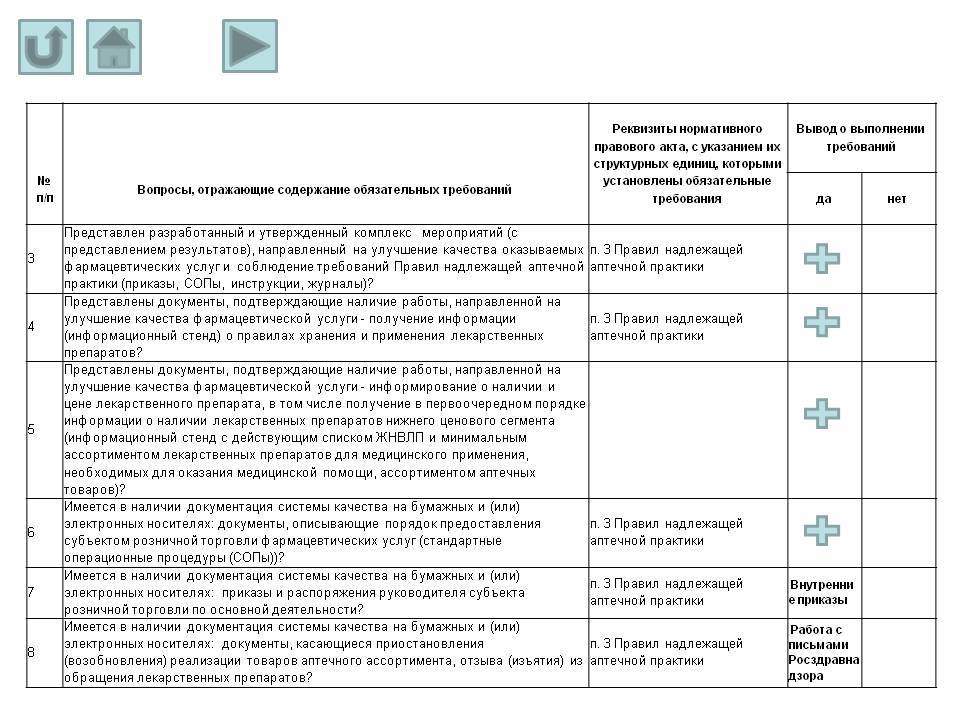
- Представлен разработанный и утвержденный комплекс мероприятий (с предоставлением результатов), направленный на улучшение качества оказываемых фармацевтических услуг и соблюдение требований Правил надлежащей аптечной практики (приказы, СОПы, инструкции, журналы)?
- Представлены документы, подтверждающие наличие работы, направленной на улучшение качества фармацевтической услуги - получение информации (информационный стенд) о правилах хранения и применения лекарственных препаратов?
- Представлены документы, подтверждающие наличие работы, направленной на улучшение качества фармацевтической услуги - информирование о наличии и цене лекарственного препарата, в том числе получение в первоочередном порядке информации о наличии лекарственных препаратов нижнего ценового сегмента (информационный стенд с действующим списком ЖНВЛП и минимальным ассортиментом лекарственных препаратов для медицинского применения, необходимых для оказания медицинской помощи, ассортиментом аптечных товаров)?
Меры подготовки организации:
Должен быть разработан внутренний приказ «О реализации комплекса мероприятий, направленных на соблюдение требований настоящих Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения».
В соответствии с требованиями п.3 Приказа № 647н с целью улучшение качества оказываемых фармацевтических услуг и соблюдения требований Правил надлежащей аптечной практики приказываю:
1.Утвердить комплекс мероприятий направленных на соблюдение требований настоящих Правил надлежащей аптечной практики ЛП для медицинского применения.
2. Ответственным за исполнение приказа назначить заместителя директора Иванову М.И.
Приложение к внутреннему приказу: «Комплекс мероприятий, направленных на соблюдение требований настоящих Правил надлежащей аптечной практики ЛП для медицинского применения»
1. На качество услуг, оказываемых ООО…, и направленных на удовлетворение спроса покупателей в товарах аптечного ассортимента влияют процессы: «закупки», «приемки», «предпродажной подготовки», «хранения», «реализации», «контроля качества».
2. Все процессы осуществляются в соответствии с утвержденными стандартными операционными процедурами.
3. Для обеспечения системы качества установить следующую последовательность осуществления процессов, в зависимости от их влияния на безопасность, эффективность и рациональность применения лекарственных препаратов:
«закупка»,
«приемка»,
«контроль качества»,
«предпродажная подготовка»,
«хранение»,
«реализация».
4. Установить, что процесс «контроль качества» взаимодействует с процессами «закупки», «приемки», «предпродажной подготовки», «хранения», «реализации» в течение всего времени их осуществления.
5. Для обеспечения системы качества, и при управлении процессами определить следующие критерии и методы достижения результатов:
- отсутствие жалоб граждан на осуществление процессов;
- отсутствие нарушений при проведении проверок контрольно-надзорных органов
- отсутствие нарушений по результатам внутреннего аудита
6. Определить следующие параметры для поддержания процессов системы качества и их мониторинга
- отсутствие жалоб граждан на осуществление процессов (количество жалоб граждан менее 5 в квартал);
- отсутствие нарушений при проведении проверок контрольно-надзорных органов (количество выявленных нарушений в ходе проверки менее 2 не грубых, отсутствие грубых нарушений);
- отсутствие нарушений по результатам внутреннего аудита (количество выявленных нарушений в ходе внутреннего аудита менее 10);
- обеспечение спроса на лекарственные средства и прочие товары аптечного ассортимента (количество рецептов на отсроченном обслуживании менее не более 5);
- обеспечение наличия минимального ассортимента (не менее 95% от установленного);
- обеспечение участия специалистов в конференциях, тренингах, вебинарах (не менее 1 раз в квартал);
- обеспечение трудовыми ресурсами (не менее 3 человек в течение рабочего дня).
7. Сотрудники ООО … обязаны информировать посетителей аптеки о правилах хранения и применения лекарственных препаратов. Информация о правилах хранения и применения лекарственных препаратов размещается на информационном стенде организации.
8. Сотрудники ООО … обязаны информировать посетителей аптеки о наличии и цене лекарственного препарата, в том числе в первоочередном порядке информации о наличии лекарственных препаратов нижнего ценового сегмента. Действующий список ЖНВЛП и минимальный ассортимент лекарственных препаратов для медицинского применения, необходимых для оказания медицинской помощи, размещается на информационном стенде.
9. Обеспечить ежеквартальный контроль за исполнением настоящего приказа, результаты контроля оформлять актом.
10. Для достижения запланированных результатов и постоянного улучшения обслуживания покупателей и повышения персональной ответственности работников обеспечить проведение внутреннего аудита не реже 1 раза в квартал.
Таким образом, важно показать контрольно-надзорному органу, что в организации есть внутренний приказ, направленный на соблюдение требований Надлежащей аптечной практики; разработаны критерии обеспечения системы качества и ведется контроль за исполнение данного приказа (оформленный актом).
- Имеется в наличии документация системы качества на бумажных и (или) электронных носителях: документы, описывающие порядок предоставления субъектом розничной торговли фармацевтических услуг (стандартные операционные процедуры (СОПы))?
Меры подготовки организации:
Наличие следующих СОПов:
«закупка»,
«приемка»,
«контроль качества»,
«предпродажная подготовка»,
«хранение»,
«реализация»,
«претензионная работа, в случае несоответствия поставленных товаров аптечного ассортимента условиям договора, данным сопроводительных документов»,
«работа по выявлению, идентификации и изолированию фальсифицированных, недоброкачественных, контрафактных товаров аптечного ассортимента».
- Имеется в наличии документация системы качества на бумажных и (или) электронных носителях:
журнал регистрации приказов (распоряжений) по субъекту розничной торговли?
журнал ежедневной регистрации параметров температуры и влажности в помещениях для хранения лекарственных препаратов?
журнал периодической регистрации температуры внутри холодильного оборудования?
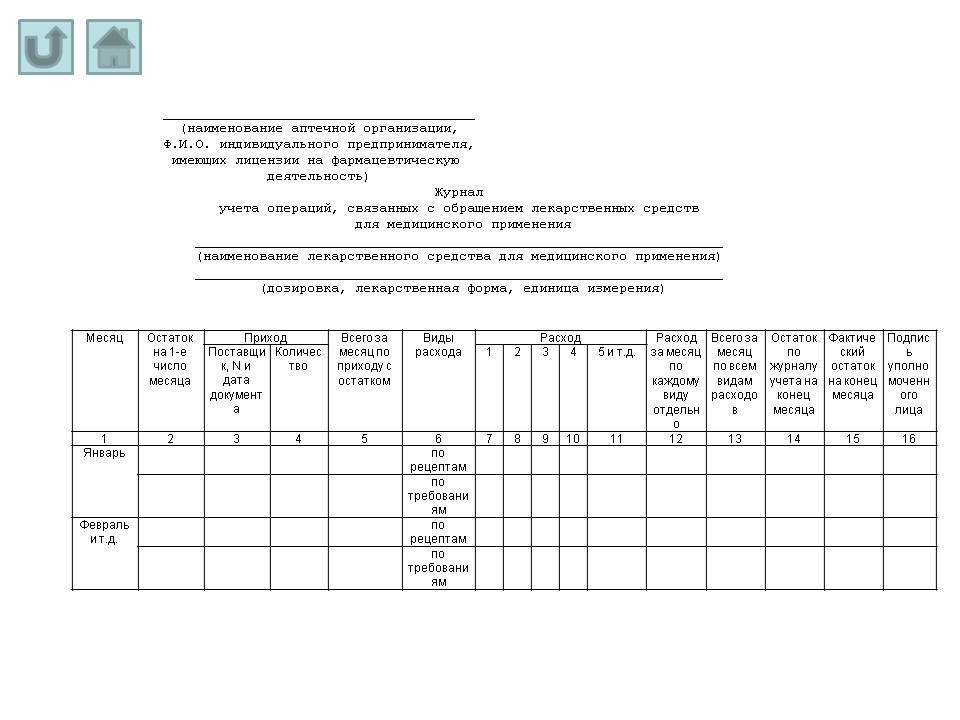
журнал учета операций, связанных с обращением лекарственных средств, включенных в перечень лекарственных средств, подлежащих предметно-количественному учету (при наличии)?
журнал учета проверок юридического лица, индивидуального предпринимателя, проводимых органами государственного контроля (надзора), органами муниципального контроля?
журнал учета лекарственных препаратов с ограниченным сроком годности?
журнал учета поступления и расхода вакцин (при наличии)?
Меры подготовки организации:
Обязательное наличие всех вышеперечисленных журналов.
Если форма журнала не регламентирована каким-либо нормативным документом (например, журнал учета операций, связанных с обращением лекарственных средств для медицинского применения – утвержден Приказом МЗ РФ от 17.06.2013 г. N 378н "Об утверждении правил регистрации операций, связанных с обращением лекарственных средств для медицинского применения, включенных в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учету, в специальных журналах учета операций, связанных с обращением лекарственных средств для медицинского применения, и правил ведения и хранения специальных журналов учета операций, связанных с обращением лекарственных средств для медицинского применения"), то она должна быть утверждена внутренним приказом организации (и это не будет являться нарушением).
- Представлены документы, подтверждающие наличие работы, направленной на улучшение качества фармацевтической услуги - получение информации (информационный стенд) о правилах хранения и применения лекарственных препаратов?
- Представлены документы, подтверждающие наличие работы, направленной на улучшение качества фармацевтической услуги - информирование о наличии и цене лекарственного препарата, в том числе получение в первоочередном порядке информации о наличии лекарственных препаратов нижнего ценового сегмента (информационный стенд с действующим списком ЖНВЛП и минимальным ассортиментом лекарственных препаратов для медицинского применения, необходимых для оказания медицинской помощи, ассортиментом аптечных товаров)?
Меры подготовки организации:
Должен быть разработан внутренний приказ «О реализации комплекса мероприятий, направленных на соблюдение требований настоящих Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения».
В соответствии с требованиями п.3 Приказа № 647н с целью улучшение качества оказываемых фармацевтических услуг и соблюдения требований Правил надлежащей аптечной практики приказываю:
1.Утвердить комплекс мероприятий направленных на соблюдение требований настоящих Правил надлежащей аптечной практики ЛП для медицинского применения.
2. Ответственным за исполнение приказа назначить заместителя директора Иванову М.И.
Приложение к внутреннему приказу: «Комплекс мероприятий, направленных на соблюдение требований настоящих Правил надлежащей аптечной практики ЛП для медицинского применения»
1. На качество услуг, оказываемых ООО…, и направленных на удовлетворение спроса покупателей в товарах аптечного ассортимента влияют процессы: «закупки», «приемки», «предпродажной подготовки», «хранения», «реализации», «контроля качества».
2. Все процессы осуществляются в соответствии с утвержденными стандартными операционными процедурами.
3. Для обеспечения системы качества установить следующую последовательность осуществления процессов, в зависимости от их влияния на безопасность, эффективность и рациональность применения лекарственных препаратов:
«закупка»,
«приемка»,
«контроль качества»,
«предпродажная подготовка»,
«хранение»,
«реализация».
4. Установить, что процесс «контроль качества» взаимодействует с процессами «закупки», «приемки», «предпродажной подготовки», «хранения», «реализации» в течение всего времени их осуществления.
5. Для обеспечения системы качества, и при управлении процессами определить следующие критерии и методы достижения результатов:
- отсутствие жалоб граждан на осуществление процессов;
- отсутствие нарушений при проведении проверок контрольно-надзорных органов
- отсутствие нарушений по результатам внутреннего аудита
6. Определить следующие параметры для поддержания процессов системы качества и их мониторинга
- отсутствие жалоб граждан на осуществление процессов (количество жалоб граждан менее 5 в квартал);
- отсутствие нарушений при проведении проверок контрольно-надзорных органов (количество выявленных нарушений в ходе проверки менее 2 не грубых, отсутствие грубых нарушений);
- отсутствие нарушений по результатам внутреннего аудита (количество выявленных нарушений в ходе внутреннего аудита менее 10);
- обеспечение спроса на лекарственные средства и прочие товары аптечного ассортимента (количество рецептов на отсроченном обслуживании менее не более 5);
- обеспечение наличия минимального ассортимента (не менее 95% от установленного);
- обеспечение участия специалистов в конференциях, тренингах, вебинарах (не менее 1 раз в квартал);
- обеспечение трудовыми ресурсами (не менее 3 человек в течение рабочего дня).
7. Сотрудники ООО … обязаны информировать посетителей аптеки о правилах хранения и применения лекарственных препаратов. Информация о правилах хранения и применения лекарственных препаратов размещается на информационном стенде организации.
8. Сотрудники ООО … обязаны информировать посетителей аптеки о наличии и цене лекарственного препарата, в том числе в первоочередном порядке информации о наличии лекарственных препаратов нижнего ценового сегмента. Действующий список ЖНВЛП и минимальный ассортимент лекарственных препаратов для медицинского применения, необходимых для оказания медицинской помощи, размещается на информационном стенде.
9. Обеспечить ежеквартальный контроль за исполнением настоящего приказа, результаты контроля оформлять актом.
10. Для достижения запланированных результатов и постоянного улучшения обслуживания покупателей и повышения персональной ответственности работников обеспечить проведение внутреннего аудита не реже 1 раза в квартал.
Таким образом, важно показать контрольно-надзорному органу, что в организации есть внутренний приказ, направленный на соблюдение требований Надлежащей аптечной практики; разработаны критерии обеспечения системы качества и ведется контроль за исполнение данного приказа (оформленный актом).
- Имеется в наличии документация системы качества на бумажных и (или) электронных носителях: документы, описывающие порядок предоставления субъектом розничной торговли фармацевтических услуг (стандартные операционные процедуры (СОПы))?
Меры подготовки организации:
Наличие следующих СОПов:
«закупка»,
«приемка»,
«контроль качества»,
«предпродажная подготовка»,
«хранение»,
«реализация»,
«претензионная работа, в случае несоответствия поставленных товаров аптечного ассортимента условиям договора, данным сопроводительных документов»,
«работа по выявлению, идентификации и изолированию фальсифицированных, недоброкачественных, контрафактных товаров аптечного ассортимента».
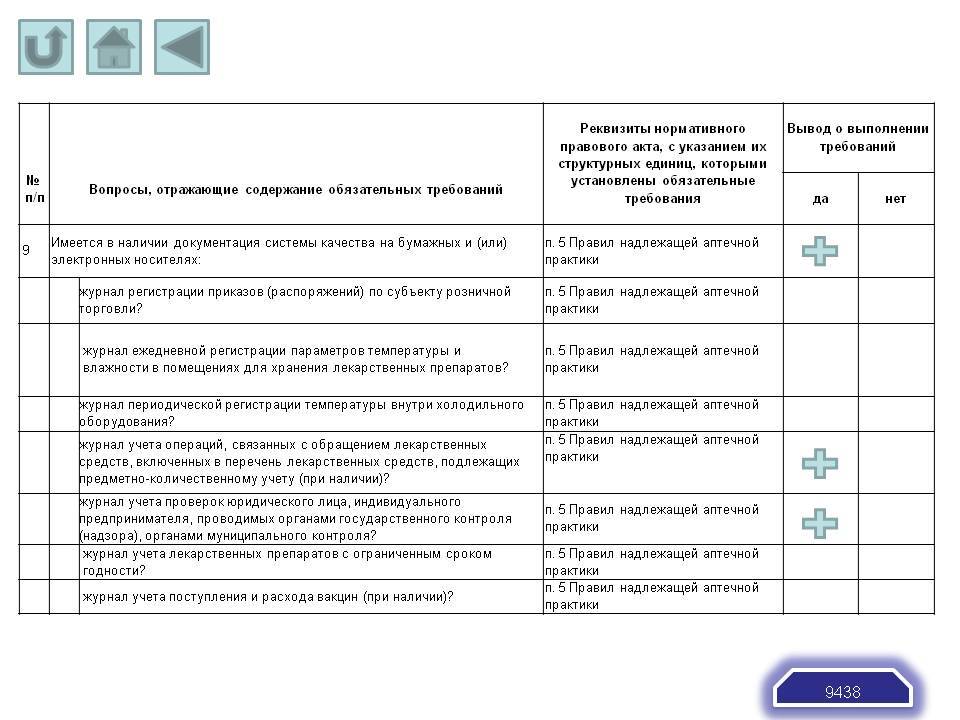
- Имеется в наличии документация системы качества на бумажных и (или) электронных носителях:
журнал регистрации приказов (распоряжений) по субъекту розничной торговли?
журнал ежедневной регистрации параметров температуры и влажности в помещениях для хранения лекарственных препаратов?
журнал периодической регистрации температуры внутри холодильного оборудования?
журнал учета операций, связанных с обращением лекарственных средств, включенных в перечень лекарственных средств, подлежащих предметно-количественному учету (при наличии)?
журнал учета проверок юридического лица, индивидуального предпринимателя, проводимых органами государственного контроля (надзора), органами муниципального контроля?
журнал учета лекарственных препаратов с ограниченным сроком годности?
журнал учета поступления и расхода вакцин (при наличии)?
Меры подготовки организации:
Обязательное наличие всех вышеперечисленных журналов.
Если форма журнала не регламентирована каким-либо нормативным документом (например, журнал учета операций, связанных с обращением лекарственных средств для медицинского применения – утвержден Приказом МЗ РФ от 17.06.2013 г. N 378н "Об утверждении правил регистрации операций, связанных с обращением лекарственных средств для медицинского применения, включенных в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учету, в специальных журналах учета операций, связанных с обращением лекарственных средств для медицинского применения, и правил ведения и хранения специальных журналов учета операций, связанных с обращением лекарственных средств для медицинского применения"), то она должна быть утверждена внутренним приказом организации (и это не будет являться нарушением).
II. Система обеспечения качества хранения и перевозки лекарственных препаратов
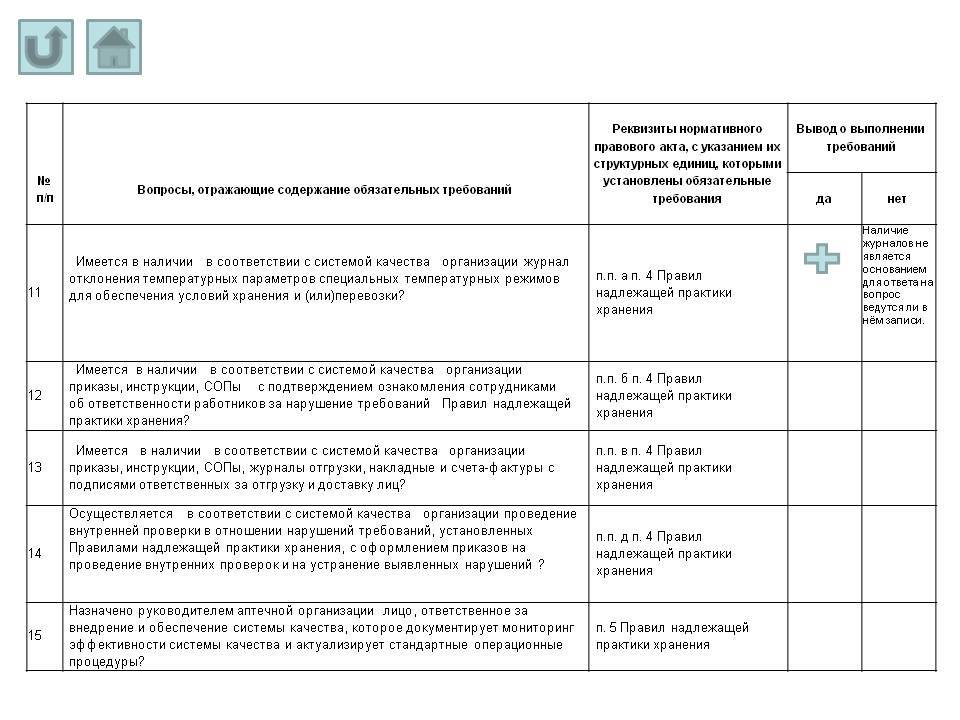
- Имеется в наличии в соответствии с системой качества организации журнал отклонения температурных параметров специальных температурных режимов для обеспечения условий хранения и (или) перевозки?
Меры подготовки организации:
Наличие внутреннего приказа «О реализации комплекса мер, направленных на соблюдение работниками Правил при хранении и (или) перевозке лекарственных препаратов»
В соответствии с требованиями п.3 Приказа № 646н приказываю:
1.Утвердить комплекс мер, направленных на соблюдение работниками Правил при хранении и (или) перевозке лекарственных препаратов (далее система качества).
2.Разработать документы, в которых регламентируются в том числе порядок совершения работниками действий при осуществлении хранения и (или) перевозке лекарственных препаратов, порядок обслуживания и поверки измерительных приборов и оборудования, ведение записей, отчетов и их хранение, прием, транспортировка, размещение лекарственных препаратов (далее - стандартные операционные процедуры), и организации контроля за соблюдением стандартных операционных процедур.
3.Система качества должна гарантировать: (взять из п.4 Приказа 646н).
4.В соответствии с системой качества:
а) утвердить форму журнала отклонения температурных параметров специальных температурных режимов для обеспечения условий хранения и (или) перевозки;
б) внутренние приказы, инструкции, СОПы должны содержать ответственность сотрудников за нарушение требований Правил надлежащей практики хранения;
в) ответственные сотрудники организации должны быть ознакомлены с внутренними приказами, инструкциями, СОПами;
г) журналы отгрузки, накладные и счета-фактуры должны содержать подписи ответственных за отгрузку и доставку лиц;
д) в случае нарушения требований, установленных Правилами надлежащей практики хранения, оформлять приказ на проведение внутренней проверки для выяснения обстоятельств и устранения выявленных нарушений;
5. Назначить ответственным за внедрение и обеспечение системы качества, документацию мониторинга эффективности системы качества и актуализацию стандартных операционных процедур Иванову И.И.;
6. Проводить мониторинг эффективности: ежеквартальный контроль, результаты которого должны быть оформлены в журнале мониторинга.
Для предотвращения допущения нарушений проводятся профилактические мероприятия (попытка минимизировать нарушения, которые могут быть допущены организациями), а именно:
- размещение на официальных сайтах государственных органов информации о требованиях/нововведениях в законодательстве;
- информирование юридических лиц и индивидуальных предпринимателей по вопросам соблюдения указанных требований;
- обобщение практики осуществления контроля (публичные слушания, на которых разбираются основные нарушения);
- предостережения: при наличии у органа государственного контроля (надзора), сведений о готовящихся нарушениях или о признаках нарушений обязательных требований, содержащихся в поступивших обращениях и заявлениях (за исключением обращений и заявлений, авторство которых не подтверждено), информации от органов государственной власти, органов местного самоуправления, из средств массовой информации в случаях, если отсутствуют подтвержденные данные о том, что нарушение обязательных требований, причинило вред жизни, здоровью граждан, и если ЮЛ, ИП ранее не привлекались к ответственности за нарушение соответствующих требований, орган государственного контроля (надзора), объявляют ЮЛ, ИП предостережение о недопустимости нарушения обязательных требований и предлагают ЮЛ, ИП принять меры по обеспечению соблюдения обязательных требований, и уведомить об этом в установленный в таком предостережении срок орган государственного контроля (надзора).
Меры подготовки организации:
Наличие внутреннего приказа «О реализации комплекса мер, направленных на соблюдение работниками Правил при хранении и (или) перевозке лекарственных препаратов»
В соответствии с требованиями п.3 Приказа № 646н приказываю:
1.Утвердить комплекс мер, направленных на соблюдение работниками Правил при хранении и (или) перевозке лекарственных препаратов (далее система качества).
2.Разработать документы, в которых регламентируются в том числе порядок совершения работниками действий при осуществлении хранения и (или) перевозке лекарственных препаратов, порядок обслуживания и поверки измерительных приборов и оборудования, ведение записей, отчетов и их хранение, прием, транспортировка, размещение лекарственных препаратов (далее - стандартные операционные процедуры), и организации контроля за соблюдением стандартных операционных процедур.
3.Система качества должна гарантировать: (взять из п.4 Приказа 646н).
4.В соответствии с системой качества:
а) утвердить форму журнала отклонения температурных параметров специальных температурных режимов для обеспечения условий хранения и (или) перевозки;
б) внутренние приказы, инструкции, СОПы должны содержать ответственность сотрудников за нарушение требований Правил надлежащей практики хранения;
в) ответственные сотрудники организации должны быть ознакомлены с внутренними приказами, инструкциями, СОПами;
г) журналы отгрузки, накладные и счета-фактуры должны содержать подписи ответственных за отгрузку и доставку лиц;
д) в случае нарушения требований, установленных Правилами надлежащей практики хранения, оформлять приказ на проведение внутренней проверки для выяснения обстоятельств и устранения выявленных нарушений;
5. Назначить ответственным за внедрение и обеспечение системы качества, документацию мониторинга эффективности системы качества и актуализацию стандартных операционных процедур Иванову И.И.;
6. Проводить мониторинг эффективности: ежеквартальный контроль, результаты которого должны быть оформлены в журнале мониторинга.
Для предотвращения допущения нарушений проводятся профилактические мероприятия (попытка минимизировать нарушения, которые могут быть допущены организациями), а именно:
- размещение на официальных сайтах государственных органов информации о требованиях/нововведениях в законодательстве;
- информирование юридических лиц и индивидуальных предпринимателей по вопросам соблюдения указанных требований;
- обобщение практики осуществления контроля (публичные слушания, на которых разбираются основные нарушения);
- предостережения: при наличии у органа государственного контроля (надзора), сведений о готовящихся нарушениях или о признаках нарушений обязательных требований, содержащихся в поступивших обращениях и заявлениях (за исключением обращений и заявлений, авторство которых не подтверждено), информации от органов государственной власти, органов местного самоуправления, из средств массовой информации в случаях, если отсутствуют подтвержденные данные о том, что нарушение обязательных требований, причинило вред жизни, здоровью граждан, и если ЮЛ, ИП ранее не привлекались к ответственности за нарушение соответствующих требований, орган государственного контроля (надзора), объявляют ЮЛ, ИП предостережение о недопустимости нарушения обязательных требований и предлагают ЮЛ, ИП принять меры по обеспечению соблюдения обязательных требований, и уведомить об этом в установленный в таком предостережении срок орган государственного контроля (надзора).

Что касается предварительной проверки, она проводится при отсутствии достоверной информации о лице, допустившем нарушение обязательных требований, достаточных данных о нарушении обязательных требований либо о фактах возникновения угрозы причинения вреда жизни, здоровью граждан или причинения вреда жизни, здоровью граждан уполномоченными должностными лицами органа государственного контроля (надзора).
В ходе проведения предварительной проверки принимаются меры по запросу дополнительных сведений и материалов (в том числе в устном порядке) у лиц, направивших заявления и обращения, представивших информацию, проводится рассмотрение документов ЮЛ, ИП, имеющихся в распоряжении органа государственного контроля (надзора).
В рамках предварительной проверки у ЮЛ, ИП могут быть запрошены пояснения в отношении полученной информации, но представление таких пояснений и иных документов не является обязательным.
Предварительная проверка не подразумевает составление акта и протокола.
(Пример: в контролирующий орган поступило обращение гражданина о том, что в организации работает специалист без необходимого сертификата (или срок его действия истек). В данном случае нет информации о том, что присутствует угроза жизни и здоровью граждан, а также информации, что ранее организация уже привлекалась к ответственности за подобное нарушение. Поэтому контролирующий орган принимает решение о проведении в отношении организации предварительной проверки. В рамках этой проверки у организации будет запрошена информация о наличии сертификата указанного специалиста и по результатам предоставленных сведений принимается решение о проведении выездной или документарной проверки (если организация не смогла предоставить запрашиваемый сертификат) или отсутствии необходимости в дальнейшей проверке (если сертификат был предоставлен).
11 декабря 2017 года на рассмотрение Государственной Думы Федерального Собрания Российской Федерации был внесен проект федерального закона "О внесении изменений в Федеральный закон №323 "Об основах охраны здоровья граждан в Российской Федерации" и статью 9 Федерального закона №61 "Об обращении лекарственных средств", который предусматривает предоставление Росздравнадзору права на проведение мероприятий по контролю в виде контрольной закупки.
Законопроектом предлагается наделить работников Росздравнадзора при проведении проверок законодательства Российской Федерации в сфере охраны здоровья и законодательства Российской Федерации об обращении лекарственных средств правом на проведение контрольной закупки в следующих случаях:
- при проверке соблюдения обязательных требований при осуществлении медицинской деятельности в части соблюдения установленного порядка предоставления платных медицинских услуг;
- при проведении федерального государственного надзора в сфере обращения лекарственных средств с целью проверки соблюдения правил отпуска лекарственных препаратов для медицинского применения и (или) соблюдения запрета продажи фальсифицированных, недоброкачественных, контрафактных лекарственных средств для медицинского применения;
- при проведении государственного контроля за обращением медицинских изделий в части запрета на реализацию фальсифицированных, недоброкачественных, контрафактных медицинских изделий.
Таким образом, необходимой мерой для каждой аптечной организации станет ежедневный мониторинг всего товарного ассортимента на наличие фальсифицированных, недоброкачественных или контрафактных лекарственных средств.
В ходе проведения предварительной проверки принимаются меры по запросу дополнительных сведений и материалов (в том числе в устном порядке) у лиц, направивших заявления и обращения, представивших информацию, проводится рассмотрение документов ЮЛ, ИП, имеющихся в распоряжении органа государственного контроля (надзора).
В рамках предварительной проверки у ЮЛ, ИП могут быть запрошены пояснения в отношении полученной информации, но представление таких пояснений и иных документов не является обязательным.
Предварительная проверка не подразумевает составление акта и протокола.
(Пример: в контролирующий орган поступило обращение гражданина о том, что в организации работает специалист без необходимого сертификата (или срок его действия истек). В данном случае нет информации о том, что присутствует угроза жизни и здоровью граждан, а также информации, что ранее организация уже привлекалась к ответственности за подобное нарушение. Поэтому контролирующий орган принимает решение о проведении в отношении организации предварительной проверки. В рамках этой проверки у организации будет запрошена информация о наличии сертификата указанного специалиста и по результатам предоставленных сведений принимается решение о проведении выездной или документарной проверки (если организация не смогла предоставить запрашиваемый сертификат) или отсутствии необходимости в дальнейшей проверке (если сертификат был предоставлен).
11 декабря 2017 года на рассмотрение Государственной Думы Федерального Собрания Российской Федерации был внесен проект федерального закона "О внесении изменений в Федеральный закон №323 "Об основах охраны здоровья граждан в Российской Федерации" и статью 9 Федерального закона №61 "Об обращении лекарственных средств", который предусматривает предоставление Росздравнадзору права на проведение мероприятий по контролю в виде контрольной закупки.
Законопроектом предлагается наделить работников Росздравнадзора при проведении проверок законодательства Российской Федерации в сфере охраны здоровья и законодательства Российской Федерации об обращении лекарственных средств правом на проведение контрольной закупки в следующих случаях:
- при проверке соблюдения обязательных требований при осуществлении медицинской деятельности в части соблюдения установленного порядка предоставления платных медицинских услуг;
- при проведении федерального государственного надзора в сфере обращения лекарственных средств с целью проверки соблюдения правил отпуска лекарственных препаратов для медицинского применения и (или) соблюдения запрета продажи фальсифицированных, недоброкачественных, контрафактных лекарственных средств для медицинского применения;
- при проведении государственного контроля за обращением медицинских изделий в части запрета на реализацию фальсифицированных, недоброкачественных, контрафактных медицинских изделий.
Таким образом, необходимой мерой для каждой аптечной организации станет ежедневный мониторинг всего товарного ассортимента на наличие фальсифицированных, недоброкачественных или контрафактных лекарственных средств.

Контрольная закупка проводится без предварительного уведомления проверяемых ЮЛ, ИП и по основаниям, предусмотренным частью 2 статьи 10 Федерального закона №294 для проведения внеплановых выездных проверок.

Контрольная закупка, организованная по данным основаниям, проводится по согласованию с органами прокуратуры.
В случае выявления нарушений обязательных требований информация о контрольной закупке должна быть предоставлена представителю ЮЛ, ИП незамедлительно после ее завершения.
Должностное лицо органа государственного контроля (надзора) должно предъявить служебное удостоверение и приказ (распоряжение) руководителя или заместителя руководителя органа государственного контроля (надзора) о проведении контрольной закупки.
Контрольная закупка (за исключением контрольной закупки, осуществляемой дистанционно с использованием информационно-коммуникационных технологий) должна проводиться в присутствии двух свидетелей либо с применением видеозаписи. В случае необходимости при проведении контрольной закупки применяются фото- и киносъемка, видеозапись, иные установленные способы фиксации.
О проведении контрольной закупки составляется акт, который подписывается должностным лицом органа государственного контроля (надзора), проводившим контрольную закупку, и свидетелями.
В случае выявления при проведении контрольной закупки нарушений обязательных требований акт о проведении контрольной закупки также представляется для подписания представителям ЮЛ, ИП, в отношении которых проводилась контрольная закупка.
При отказе представителей ЮЛ, ИП от подписания акта о проведении контрольной закупки в акт вносятся сведения об отказе от совершения подписи.
ЮЛ, ИП, в отношении которых проводилась контрольная закупка, в результате которой были выявлены нарушения обязательных требований, экземпляр акта о проведении контрольной закупки вручается незамедлительно после его составления.
Отдельно рассмотрим административную ответственность, предусмотренную за допущение тех или иных нарушений, выявленных при проведении проверок в рамках лицензионного контроля или федерального государственного надзора.
В случае выявления нарушений обязательных требований информация о контрольной закупке должна быть предоставлена представителю ЮЛ, ИП незамедлительно после ее завершения.
Должностное лицо органа государственного контроля (надзора) должно предъявить служебное удостоверение и приказ (распоряжение) руководителя или заместителя руководителя органа государственного контроля (надзора) о проведении контрольной закупки.
Контрольная закупка (за исключением контрольной закупки, осуществляемой дистанционно с использованием информационно-коммуникационных технологий) должна проводиться в присутствии двух свидетелей либо с применением видеозаписи. В случае необходимости при проведении контрольной закупки применяются фото- и киносъемка, видеозапись, иные установленные способы фиксации.
О проведении контрольной закупки составляется акт, который подписывается должностным лицом органа государственного контроля (надзора), проводившим контрольную закупку, и свидетелями.
В случае выявления при проведении контрольной закупки нарушений обязательных требований акт о проведении контрольной закупки также представляется для подписания представителям ЮЛ, ИП, в отношении которых проводилась контрольная закупка.
При отказе представителей ЮЛ, ИП от подписания акта о проведении контрольной закупки в акт вносятся сведения об отказе от совершения подписи.
ЮЛ, ИП, в отношении которых проводилась контрольная закупка, в результате которой были выявлены нарушения обязательных требований, экземпляр акта о проведении контрольной закупки вручается незамедлительно после его составления.
Отдельно рассмотрим административную ответственность, предусмотренную за допущение тех или иных нарушений, выявленных при проведении проверок в рамках лицензионного контроля или федерального государственного надзора.





Что касается статьи 14.43,так как требования технического регламента не утверждены, то в данном случае речь идет о правилах хранения, перевозки, реализации и утилизации.



Полезная статья? Поделитесь в соцсетях:
Остались вопросы? Задайте их в комментариях, и наши эксперты вам ответят: